La navaja de Occam o la tríada de Saint?, o las dos cosas?
Una mujer de 60 años con una historia confirmada de artritis reumatoidea seronegativa, se presentó al departamento de emergencia con un cuadro de 10 días de evolución de empeoramiento de su disnea al esfuerzo, tos no productiva y sensación de fiebre, y 7 días de evolución de dolor en muslo y región glútea derecha que limitaban su movilidad. No había expectoración, ortopnea, disnea paroxística nocturna ni dolor torácico o pleurítico.
La paciente había sido evaluada por su médico de cabecera unos días antes. Una Rx de tórax y un eco doppler de miembro inferior derecho no habían mostrado alteraciones. Se prescribió un antihistamínico por interpretarse el cuadro como rinitis alérgica. Su disnea empeoró, y la mañana de su internación el paciente fue visto por su reumatólogo, quien la notó febril, taquipneica e hipoxémica.
La historia de la paciente incluía: síndrome CREST (calcinosis, Raynaud, disfunción esofágica, esclerodactilia y telangiectasia), artroplastia de cadera derecha con trombosis venosa profunda posoperatoria 5 años antes, e hipotiroidismo. La paciente tenía una relación monogámica desde hacía 30 años. Ocasionalmente tomaba alcohol, no fumaba ni usaba drogas ilícitas. Su artritis inflamatoria estaba tratada con 5 mg de prednisona 1 vez por día (durante los últimos 10 años), 25 mg de metotrexato subcutáneos por semana (los últimos 11 meses) y 300 mg de infliximab intravenosos cada 8 semanas (los últimos 4 meses). Su status con respecto a la PPD era desconocido. Medicación adicional incluía: levotiroxina, hidrocodona, acetaminofen, alendronato y ácido fólico.
La paciente estaba alerta con moderado distress respiratorio. Su temperatura era de 38,3 °C, y su frecuencia cardiaca de 84 por minuto, su TA de 130/72 mmHg, su frecuencia respiratoria de 24 por minuto y su saturación de O2 era de 75% respirando aire ambiente. Usaba sus músculos accesorios para respirar. La auscultación revelaba rales en los campos pulmonares inferiores y matidez a la percusión de las bases. No había frote pleural. El examen cardiovascular mostró un primer ruido normal pero un Segundo ruido prominente sin soplo de insuficiencia tricuspídea. No había ingurgitación yugular. Presentaba cambios hipertróficos de las metacarpofalángicas e interfalángicas proximales junto a desviación cubital. Había múltiples telangiectasias en la cara y los brazos pero no había rash ni nódulos. El examen de la cadera derecha no despertaba dolor acetabular, la movilidad de la cadera estaba conservada y no había dolor, edema ni tumefacción en las pantorrillas.
El recuento de blancos fue de 8000/mm3 con un conteo diferencial normal, el hematocrito 35% y el recuento de plaquetas fue de 142000/mm3, KPTT 30 seg (normal 19 a 30), y el RIN de 0,9. La AST fue de 107 (hasta 48), ALT de 55, bicarbonato de 19 meq/l, la PCR fue de 12,4 mg/ dl (normal 0,020 a 0,8), y la LDH 1142 (normal 104 a 236). La FAL, bilirrubina directa e indirecta, glucosa, creatinina, urea fueron normales. La PO2 arterial de 230 mmHg (respirando O2 por máscara), y la PCO2 de 29 mm H, y el pH de 7,45. La Rx de tórax mostró infiltrados en ambos campos pulmonares. El ECG fue normal.
Se obtuvieron cultivos de esputo y se comenzó con terapia empírica con levofloxacina y TMS intravenosos asociado a corticosteroides.
Cual es el diagnóstico?
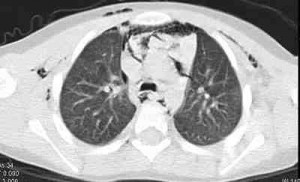
Una angio TAC helicoidal de tórax (Figutra 1)mostró una gran embolia en la arteria pulmonar principal derecha, arterias segmentarias derechas, y subsegmentarias derechas. La TAC también mostró infiltrados periféricos en “vidrio esmerilado” (Figura 2).
El paciente recibió un bolo de heparina intravenosa seguida por una infusión continua de heparina no fraccionada. Su status clínico permaneció igual no mejorando durante las horas siguientes entre la administración de heparina y la realización de la broncoscopía con lavado broncoalveolar. Este último reveló la presencia de Pneumocystis carinii. Por lo tanto, comenzó a recibir trimetoprima-sulfametoxazol, corticoides junto a la heparina no fraccionada. Ella requirió ARM durante 24 horas después de la broncoscopía, pero al cabo de este tiempo su condición mejoró dramáticame nte. Su traquea fue extubada el segundo día de hospital. Al quinto día se retiró el oxígeno suplementario y desapareció su disnea de reposo. La paciente fue dada de alta rápidamente tomando corticoides con dosis descendentes), trimetoprima-sulfametoxazol como profilaxis. Cinco meses después del alta la paciente se encuentra bien y no refiere dificultad respiratoria.
nte. Su traquea fue extubada el segundo día de hospital. Al quinto día se retiró el oxígeno suplementario y desapareció su disnea de reposo. La paciente fue dada de alta rápidamente tomando corticoides con dosis descendentes), trimetoprima-sulfametoxazol como profilaxis. Cinco meses después del alta la paciente se encuentra bien y no refiere dificultad respiratoria.
Comentario« Pluralitas non est ponenda sine necessitate »— William of Occam, 14th century
La razón de Occam o la tríada de Saint?C Saint, un cirujano sudafricano, varias décadas atrás, enfatizó la importancia de considerar la posibilidad de múltiples enfermedades separadas en un paciente, cada vez que su historia o su examen fueran atípicos para un único diagnóstico. La tríada que lleva su nombre es la asociación de hernia hiatal, litiasis vesicular y diverticulosis colónica. No hay base patofisiológica para la coexistencia de estas tres enfermedades. Esto quizás sea el punto. Saint enfatizó que más de una enfermedad pueden ser la causa de los síntomas y signos en un mismo paciente. En el mismo sentido una frase probablemente apócrifa atribuida a John Hickam dice. "A patient can have as many diagnoses as he darn well pleases." (un paciente puede tener tantos diagnósticos como le de en gana) esto es lo que se llama “Hickam’s dictum”, o la sentencia de Hickam . Debido a que los médicos nos enfrentamos a un número creciente de pacientes con una multitud de condiciones agudas y crónicas, la visión de Saint y de Hickam requieren consideración en la práctica de la medicina moderna.
Nadie es talvez más conocido que William Osler, como representante de los defensores de la teoría del “unicismo”, el tratar de explicar los síntomas y signos del paciente con un único diagnóstico, y la aplicación de este principio en la práctica y en la enseñanza de la medicina.
“Pluralitas non est ponenda sine necesitate” o la pluralidad no se debe postular sin necesidad.
Este principio, atribuido al fraile franciscano inglés del siglo XIV Guillermo de Ockham u Occam, que forma la base del reduccionismo metodológico. Este principio ya formaba parte de la filosofía medieval aunque fue Occam quien utilizó este principio de forma filosófica.
"Pluralitas non est ponenda sine neccesitate" o la pluralidad no se debe postular sin necesidad. En su forma más simple, el principio de Occam indica que las explicaciones nunca deben multiplicar las causas sin necesidad. Cuando dos explicaciones se ofrecen para un fenómeno, la explicación completa más simple es preferible. Si un árbol achicharrado está caído en tierra, podría ser debido a la caída de un rayo o debido a un programa secreto de armas del gobierno. La explicación más simple y suficiente es la más probable —mas no necesariamente la verdadera—, según el principio de Occam. En el caso del árbol, sería la caída del rayo. Por ejemplo, si uno se encuentra en una ciudad y escucha galopar, es posible que se trate de caballos o cebras, pero se debe optar por considerar que son caballos ya que es la opción mas probable (aunque no es necesariamente la verdadera).
Este principio, llamado la “navaja de Occam” es llamado también principio de economía o de parsimonia, y es una herramienta importante en la práctica médica. Sin embargo, este principio puede no servirnos a veces, o puede fallar otras.
A medida que la población envejece, y que mucha mas cantidad de personas llegan a edades avanzadas, la probabilidad que éstas presenten simultaneamente dos, tres, o más diagnósticos aumenta. Este paciente, por ejemplo, tenía disnea por embolia pulmonar y neumonía por P carinii.
Porqué aplicar la sentencia de Hickam o la filosofía de Saint en este caso particular? Este paciente tenía artritis inflamatoria que requería terapia inmunosupresora para controlar sus síntomas. La inmunosupresión crónica lo pone en riesgo de infecciones oportunistas como por ejemplo neumonía por P carinii, que puede a su vez dar fiebre, disnea y malestar general, lo que a su vez pueden llevar al paciente a reducir su actividad física, y esto conducirlo a un mayor riesgo de tromboembolismo venoso. Aunque esto es solo una hipótesis, ésta línea de razonamiento provee una explicación para riesgos de múltiples enfermedades aparentemente no relacionadas.
Como mantener un equilibrio utilizando la filosofía de Occam o la de Saint en la práctica de la medicina en nuestros tiempos? Tenemos que convivir con ambas, porque ambas son útiles, pero tenemos que acostumbrarnos a no mirar la navaja como sinónimo de facilismo o de mala práctica de la medicina, y a saber que no siempre se puede ser unicista. Esto no significa abandonar el principio de parsimonia que se nos ha inculcado desde el comienzo de nuestra formación universitaria, ni que ante un paciente determinado pensemos que tiene una enfermedad articular, más una enfermedad de piel, más una enfermedad de riñón, y no simplemente pensar que tiene lupus eritematoso, sino que significa tener la mente abierta a otras posibilidades cuando el caso no parece resolverse con una explicación única.
Llevado a la práctica cotidiana es casi una rutina ver en la sala todas las mañanas, pacientes de mas de 80 años internados por disnea. Y también es también un acto reflejo tratar de buscarle una única explicación a la misma. Sin embargo, no pocas veces deberemos concluir que ese paciente tiene múltiples condiciones que contribuyen a sus síntomas. Un componente bronquial, quizás como expresión de reagudización de su EPOC, probablemente tenga un componente neumónico, aunque no necesariamente un block neumónico, quizá tenga algún componente restrictivo por mal trabajo respiratorio como resultado de su condición muscular deteriorada, quizás su mala condición aeróbica esté contribuyendo, y quizás, su disfunción diastólica a través de un aumento de la presión capilar pulmonar esté estimulando a los receptores j aún sin componente radiológico de congestión, contribuyendo todos ellos a la disnea.
Tenemos que acostumbrarnos a convivir con la pluralidad de diagnósticos, y cuando se puede, cortar con la navaja, pero cuando esto no es posible, el tridente de Saint siempre debe estar disponible.Fuente:
Anthony A. Hilliard, M.D., Steven E. Weinberger, M.D., Lawrence M. Tierney, Jr., M.D., David E. Midthun, M.D., and Sanjay Saint, M.D., M.P.H.
Department of Medicine (A.A.H.) and the Division of Pulmonary and Critical Care Medicine (D.E.M.), Mayo Clinic and Foundation, Rochester, Minn.; the Department of Medicine, Beth Israel Deaconess Medical Center and Harvard Medical School, Boston (S.E.W.); the San Francisco Veterans Affairs Medical Center and the University of California, San Francisco School of Medicine, San Francisco (L.M.T.); and the Ann Arbor Veterans Affairs Health Services Research and Development Center of Excellence and the Department of Internal Medicine, University of Michigan — both in Ann Arbor (S.S.).
La paciente había sido evaluada por su médico de cabecera unos días antes. Una Rx de tórax y un eco doppler de miembro inferior derecho no habían mostrado alteraciones. Se prescribió un antihistamínico por interpretarse el cuadro como rinitis alérgica. Su disnea empeoró, y la mañana de su internación el paciente fue visto por su reumatólogo, quien la notó febril, taquipneica e hipoxémica.
La historia de la paciente incluía: síndrome CREST (calcinosis, Raynaud, disfunción esofágica, esclerodactilia y telangiectasia), artroplastia de cadera derecha con trombosis venosa profunda posoperatoria 5 años antes, e hipotiroidismo. La paciente tenía una relación monogámica desde hacía 30 años. Ocasionalmente tomaba alcohol, no fumaba ni usaba drogas ilícitas. Su artritis inflamatoria estaba tratada con 5 mg de prednisona 1 vez por día (durante los últimos 10 años), 25 mg de metotrexato subcutáneos por semana (los últimos 11 meses) y 300 mg de infliximab intravenosos cada 8 semanas (los últimos 4 meses). Su status con respecto a la PPD era desconocido. Medicación adicional incluía: levotiroxina, hidrocodona, acetaminofen, alendronato y ácido fólico.
La paciente estaba alerta con moderado distress respiratorio. Su temperatura era de 38,3 °C, y su frecuencia cardiaca de 84 por minuto, su TA de 130/72 mmHg, su frecuencia respiratoria de 24 por minuto y su saturación de O2 era de 75% respirando aire ambiente. Usaba sus músculos accesorios para respirar. La auscultación revelaba rales en los campos pulmonares inferiores y matidez a la percusión de las bases. No había frote pleural. El examen cardiovascular mostró un primer ruido normal pero un Segundo ruido prominente sin soplo de insuficiencia tricuspídea. No había ingurgitación yugular. Presentaba cambios hipertróficos de las metacarpofalángicas e interfalángicas proximales junto a desviación cubital. Había múltiples telangiectasias en la cara y los brazos pero no había rash ni nódulos. El examen de la cadera derecha no despertaba dolor acetabular, la movilidad de la cadera estaba conservada y no había dolor, edema ni tumefacción en las pantorrillas.
El recuento de blancos fue de 8000/mm3 con un conteo diferencial normal, el hematocrito 35% y el recuento de plaquetas fue de 142000/mm3, KPTT 30 seg (normal 19 a 30), y el RIN de 0,9. La AST fue de 107 (hasta 48), ALT de 55, bicarbonato de 19 meq/l, la PCR fue de 12,4 mg/ dl (normal 0,020 a 0,8), y la LDH 1142 (normal 104 a 236). La FAL, bilirrubina directa e indirecta, glucosa, creatinina, urea fueron normales. La PO2 arterial de 230 mmHg (respirando O2 por máscara), y la PCO2 de 29 mm H, y el pH de 7,45. La Rx de tórax mostró infiltrados en ambos campos pulmonares. El ECG fue normal.
Se obtuvieron cultivos de esputo y se comenzó con terapia empírica con levofloxacina y TMS intravenosos asociado a corticosteroides.
Cual es el diagnóstico?

Una angio TAC helicoidal de tórax (Figutra 1)mostró una gran embolia en la arteria pulmonar principal derecha, arterias segmentarias derechas, y subsegmentarias derechas. La TAC también mostró infiltrados periféricos en “vidrio esmerilado” (Figura 2).
El paciente recibió un bolo de heparina intravenosa seguida por una infusión continua de heparina no fraccionada. Su status clínico permaneció igual no mejorando durante las horas siguientes entre la administración de heparina y la realización de la broncoscopía con lavado broncoalveolar. Este último reveló la presencia de Pneumocystis carinii. Por lo tanto, comenzó a recibir trimetoprima-sulfametoxazol, corticoides junto a la heparina no fraccionada. Ella requirió ARM durante 24 horas después de la broncoscopía, pero al cabo de este tiempo su condición mejoró dramáticame
 nte. Su traquea fue extubada el segundo día de hospital. Al quinto día se retiró el oxígeno suplementario y desapareció su disnea de reposo. La paciente fue dada de alta rápidamente tomando corticoides con dosis descendentes), trimetoprima-sulfametoxazol como profilaxis. Cinco meses después del alta la paciente se encuentra bien y no refiere dificultad respiratoria.
nte. Su traquea fue extubada el segundo día de hospital. Al quinto día se retiró el oxígeno suplementario y desapareció su disnea de reposo. La paciente fue dada de alta rápidamente tomando corticoides con dosis descendentes), trimetoprima-sulfametoxazol como profilaxis. Cinco meses después del alta la paciente se encuentra bien y no refiere dificultad respiratoria.Comentario« Pluralitas non est ponenda sine necessitate »— William of Occam, 14th century
La razón de Occam o la tríada de Saint?C Saint, un cirujano sudafricano, varias décadas atrás, enfatizó la importancia de considerar la posibilidad de múltiples enfermedades separadas en un paciente, cada vez que su historia o su examen fueran atípicos para un único diagnóstico. La tríada que lleva su nombre es la asociación de hernia hiatal, litiasis vesicular y diverticulosis colónica. No hay base patofisiológica para la coexistencia de estas tres enfermedades. Esto quizás sea el punto. Saint enfatizó que más de una enfermedad pueden ser la causa de los síntomas y signos en un mismo paciente. En el mismo sentido una frase probablemente apócrifa atribuida a John Hickam dice. "A patient can have as many diagnoses as he darn well pleases." (un paciente puede tener tantos diagnósticos como le de en gana) esto es lo que se llama “Hickam’s dictum”, o la sentencia de Hickam . Debido a que los médicos nos enfrentamos a un número creciente de pacientes con una multitud de condiciones agudas y crónicas, la visión de Saint y de Hickam requieren consideración en la práctica de la medicina moderna.
Nadie es talvez más conocido que William Osler, como representante de los defensores de la teoría del “unicismo”, el tratar de explicar los síntomas y signos del paciente con un único diagnóstico, y la aplicación de este principio en la práctica y en la enseñanza de la medicina.
“Pluralitas non est ponenda sine necesitate” o la pluralidad no se debe postular sin necesidad.
Este principio, atribuido al fraile franciscano inglés del siglo XIV Guillermo de Ockham u Occam, que forma la base del reduccionismo metodológico. Este principio ya formaba parte de la filosofía medieval aunque fue Occam quien utilizó este principio de forma filosófica.
"Pluralitas non est ponenda sine neccesitate" o la pluralidad no se debe postular sin necesidad. En su forma más simple, el principio de Occam indica que las explicaciones nunca deben multiplicar las causas sin necesidad. Cuando dos explicaciones se ofrecen para un fenómeno, la explicación completa más simple es preferible. Si un árbol achicharrado está caído en tierra, podría ser debido a la caída de un rayo o debido a un programa secreto de armas del gobierno. La explicación más simple y suficiente es la más probable —mas no necesariamente la verdadera—, según el principio de Occam. En el caso del árbol, sería la caída del rayo. Por ejemplo, si uno se encuentra en una ciudad y escucha galopar, es posible que se trate de caballos o cebras, pero se debe optar por considerar que son caballos ya que es la opción mas probable (aunque no es necesariamente la verdadera).
Este principio, llamado la “navaja de Occam” es llamado también principio de economía o de parsimonia, y es una herramienta importante en la práctica médica. Sin embargo, este principio puede no servirnos a veces, o puede fallar otras.
A medida que la población envejece, y que mucha mas cantidad de personas llegan a edades avanzadas, la probabilidad que éstas presenten simultaneamente dos, tres, o más diagnósticos aumenta. Este paciente, por ejemplo, tenía disnea por embolia pulmonar y neumonía por P carinii.
Porqué aplicar la sentencia de Hickam o la filosofía de Saint en este caso particular? Este paciente tenía artritis inflamatoria que requería terapia inmunosupresora para controlar sus síntomas. La inmunosupresión crónica lo pone en riesgo de infecciones oportunistas como por ejemplo neumonía por P carinii, que puede a su vez dar fiebre, disnea y malestar general, lo que a su vez pueden llevar al paciente a reducir su actividad física, y esto conducirlo a un mayor riesgo de tromboembolismo venoso. Aunque esto es solo una hipótesis, ésta línea de razonamiento provee una explicación para riesgos de múltiples enfermedades aparentemente no relacionadas.
Como mantener un equilibrio utilizando la filosofía de Occam o la de Saint en la práctica de la medicina en nuestros tiempos? Tenemos que convivir con ambas, porque ambas son útiles, pero tenemos que acostumbrarnos a no mirar la navaja como sinónimo de facilismo o de mala práctica de la medicina, y a saber que no siempre se puede ser unicista. Esto no significa abandonar el principio de parsimonia que se nos ha inculcado desde el comienzo de nuestra formación universitaria, ni que ante un paciente determinado pensemos que tiene una enfermedad articular, más una enfermedad de piel, más una enfermedad de riñón, y no simplemente pensar que tiene lupus eritematoso, sino que significa tener la mente abierta a otras posibilidades cuando el caso no parece resolverse con una explicación única.
Llevado a la práctica cotidiana es casi una rutina ver en la sala todas las mañanas, pacientes de mas de 80 años internados por disnea. Y también es también un acto reflejo tratar de buscarle una única explicación a la misma. Sin embargo, no pocas veces deberemos concluir que ese paciente tiene múltiples condiciones que contribuyen a sus síntomas. Un componente bronquial, quizás como expresión de reagudización de su EPOC, probablemente tenga un componente neumónico, aunque no necesariamente un block neumónico, quizá tenga algún componente restrictivo por mal trabajo respiratorio como resultado de su condición muscular deteriorada, quizás su mala condición aeróbica esté contribuyendo, y quizás, su disfunción diastólica a través de un aumento de la presión capilar pulmonar esté estimulando a los receptores j aún sin componente radiológico de congestión, contribuyendo todos ellos a la disnea.
Tenemos que acostumbrarnos a convivir con la pluralidad de diagnósticos, y cuando se puede, cortar con la navaja, pero cuando esto no es posible, el tridente de Saint siempre debe estar disponible.Fuente:
Anthony A. Hilliard, M.D., Steven E. Weinberger, M.D., Lawrence M. Tierney, Jr., M.D., David E. Midthun, M.D., and Sanjay Saint, M.D., M.P.H.
Department of Medicine (A.A.H.) and the Division of Pulmonary and Critical Care Medicine (D.E.M.), Mayo Clinic and Foundation, Rochester, Minn.; the Department of Medicine, Beth Israel Deaconess Medical Center and Harvard Medical School, Boston (S.E.W.); the San Francisco Veterans Affairs Medical Center and the University of California, San Francisco School of Medicine, San Francisco (L.M.T.); and the Ann Arbor Veterans Affairs Health Services Research and Development Center of Excellence and the Department of Internal Medicine, University of Michigan — both in Ann Arbor (S.S.).