Una mujer de 17 años con dolor torácico y hemoptisis.
Presentación del caso:
Dr. Mary Shannon Fracchia (Pediatría): Una muchacha de 17 años fue derivada a este hospital debido a dolor torácico y hemoptisis. Ella había estado bien excepto por asma leve hasta 4 meses antes de la internación, momento en que comenzó a presentar edema en miembros inferiores; se hicieron análisis en ese momento que mostraron proteinuria 3+, hematuria, e hiperlipemia.
Un mes más tarde se llevó a cabo una biopsia renal en otro hospital, y se realizó un diagnóstico de glomerulonefritis membranosa. En ese momento se realizaron tests de anticuerpos contra hepatitis B y hepatitis C, así como anti-ribonucleoproteínas, anti-topoisomerasa I, anti-Sm, anti-Ro (SS-A), anti-LA(SS-B), anti- DNA de doble cadena, y FAN que fueron todos negativos. Los niveles de complemento C3 y C4 eran normales.
Se la medicó con enalapril, atorvastatin, y restricción hídrica; después de varias semanas de tratamiento, la paciente discontinuó el atorvastatin debido a dolores musculares.
Después de la biopsia renal la paciente se quejó de dolor persistente en la región lumbar y en el abdomen. Una ultrasonografía renal demostró un pequeño hematoma perirrenal.
En los 2 meses posteriores se llevaron a cabo ecografías que mostraron disminución en el tamaño del hematoma, aunque la paciente se siguió quejando de dolor severo en región lumbar así como dolor abdominal, que persistió a pesar del tratamiento con oxicodona y acetaminofeno, llegando a interferir con sus actividades y con el sueño, haciendo que la paciente debiera permanecer mucho tiempo en cama. El edema en miembros inferiores era intermitente. Durante las 2 semanas antes de su internación , el dolor lumbar y abdominal disminuyó en intensidad, pero comenzó a tener doloren el tórax, irradiado a cuello y hombros, y que se exacerbaba con la tos y la inspiración profunda.
Seis días antes de la internación, consultó a una clínica de dolor, donde se le realizó diagnóstico de neuralgia intercostal prescribiéndosele gabapentin y tramadol. En los siguientes días el dolor empeoró, y se agregaron tos y hemoptisis, y además tuvo un episodio de disnea, que se alivió con el uso de albuterol inhalado.
El día antes de la internación, ella consultó en otro hospital debido a aumento del dolor torácico. En ese momento la temperatura era de 39ºC, la presión arterial de 115/69, y la frecuencia cardíaca de 156 por minuto. La saturación de oxígeno era de 98% mientras la paciente respiraba aire ambiente. Al examen, su respiración era superficial debido a limitación por dolor. Los campos pulmonares se auscultaban claros, y el resto del examen físico era normal. Se le administraron 2 litros de solución salina normal en el departamento de emergencias, y posteriormente la paciente fue admitida a la unidad de cuidados intensivos pediátricos.
Se la medicó con enalapril, atorvastatin, y restricción hídrica; después de varias semanas de tratamiento, la paciente discontinuó el atorvastatin debido a dolores musculares.
Después de la biopsia renal la paciente se quejó de dolor persistente en la región lumbar y en el abdomen. Una ultrasonografía renal demostró un pequeño hematoma perirrenal.
En los 2 meses posteriores se llevaron a cabo ecografías que mostraron disminución en el tamaño del hematoma, aunque la paciente se siguió quejando de dolor severo en región lumbar así como dolor abdominal, que persistió a pesar del tratamiento con oxicodona y acetaminofeno, llegando a interferir con sus actividades y con el sueño, haciendo que la paciente debiera permanecer mucho tiempo en cama. El edema en miembros inferiores era intermitente. Durante las 2 semanas antes de su internación , el dolor lumbar y abdominal disminuyó en intensidad, pero comenzó a tener doloren el tórax, irradiado a cuello y hombros, y que se exacerbaba con la tos y la inspiración profunda.
Seis días antes de la internación, consultó a una clínica de dolor, donde se le realizó diagnóstico de neuralgia intercostal prescribiéndosele gabapentin y tramadol. En los siguientes días el dolor empeoró, y se agregaron tos y hemoptisis, y además tuvo un episodio de disnea, que se alivió con el uso de albuterol inhalado.
El día antes de la internación, ella consultó en otro hospital debido a aumento del dolor torácico. En ese momento la temperatura era de 39ºC, la presión arterial de 115/69, y la frecuencia cardíaca de 156 por minuto. La saturación de oxígeno era de 98% mientras la paciente respiraba aire ambiente. Al examen, su respiración era superficial debido a limitación por dolor. Los campos pulmonares se auscultaban claros, y el resto del examen físico era normal. Se le administraron 2 litros de solución salina normal en el departamento de emergencias, y posteriormente la paciente fue admitida a la unidad de cuidados intensivos pediátricos.
Se inició tratamiento con enoxaparina. La saturación de oxígeno cayó a 92/93% por lo que se comenzó a administrar oxígeno por cánula nasal a un ritmo de 1 a 2 litros por minuto. Los resultados de los análisis de orina fueron positivos para proteínas (3+) y para sangre (2+), y tenían una densidad de 1041. La Rx de tórax reveló una densidad heterogénea en el ángulo costofrénico izquierdo, y el ECG mostró taquicardia sinusal. Se le administró sulfato de morfina para el dolor y se enviaron muestras de sangre para hemocultivos.
Al día siguiente, un ecocardiograma transtorácico mostró moderada dilatación ventricular derecha con una presión estimada de 60 mmHg en la arteria pulmonar; un aplanamiento y movimiento paradojal del septum fue observado, así como un pequeño derrame pericárdico. No se observaron trombos auriculares ni ventriculares. Después de un tratamiento preventivo con acetilcisteína y bicarbonato, una TAC espiralada y una angio-TAC de tórax fueron llevadas a cabo.
Al día siguiente, un ecocardiograma transtorácico mostró moderada dilatación ventricular derecha con una presión estimada de 60 mmHg en la arteria pulmonar; un aplanamiento y movimiento paradojal del septum fue observado, así como un pequeño derrame pericárdico. No se observaron trombos auriculares ni ventriculares. Después de un tratamiento preventivo con acetilcisteína y bicarbonato, una TAC espiralada y una angio-TAC de tórax fueron llevadas a cabo.
Había émbolos en ambas arterias pulmonares con múltiples infartos pulmonares y pequeño derrame pleural bilateral.
La ultrasonografía renal reveló un hematoma alrededor del riñón izquierdo; Los estudios con eco-Doppler no mostraron trombos en la vena cava inferior y los tests no invasivos de las piernas no demostraron trombosis venosa profunda. La enoxaparina fue discontinuada y se comenzó tratamiento con heparina sódica; la paciente fue transferida a este hospital donde fue admitida a la unidad de terapia intensiva.
La paciente tenía asma leve intermitente, que ocasionalmente requería uso de albuterol inhalado, sobre todo cuando presentaba episodios infecciosos de vías aéreas superiores, pero nunca había sido internada antes. Ella era una buena estudiante de la secundaria, y no fumaba ni tomaba alcohol, o drogas ilícitas. Su madre tenía esclerosis múltiple y asma, su padre tenía hipertensión y una prima segunda tenía LES. Un tío paterno recibía diálisis por causa que ella ni sus familiares conocían. Su madre tenía dos hermanos que tenían talasemia menor, y su hermana melliza estaba sana. La paciente tomaba anticonceptivos orales desde hacía 3 años, para tratamiento de irregularidades menstruales. Su medicación durante la internación en el otro hospital incluia: heparina, morfina, ranitidina, albuterol, y solución fisioglucosada.
En su internación en este hospital su temperatura era de 38,3ºC, el pulso de 148 por minuto, la TA de 138/72 mmHg, la frecuencia respiratoria de 34 por minuto, y la saturación de oxígeno de 92% mientras la paciente respiraba aire ambiente. Se auscultaba un 2º ruido fuerte. La columna venosa yugular, medidas con la paciente reclinada a 30º era de 7 cm por encima del ángulo esternal. Se palpaba el latido de la pulmonar, y del ventrículo derecho, y se auscultaba un soplo sistólico rudo grado 2/6 en el borde esternal izquierdo. Había dolor en el hemiabdomen derecho, y edema 1+ en ambos miembros inferiores hasta las rodillas.
Un ECG reveló una onda S en derivación D1 y una ond Q y ondas T negativas en D3. Los resultados de laboratorio se muestran en la Tabla 1.
La paciente tenía asma leve intermitente, que ocasionalmente requería uso de albuterol inhalado, sobre todo cuando presentaba episodios infecciosos de vías aéreas superiores, pero nunca había sido internada antes. Ella era una buena estudiante de la secundaria, y no fumaba ni tomaba alcohol, o drogas ilícitas. Su madre tenía esclerosis múltiple y asma, su padre tenía hipertensión y una prima segunda tenía LES. Un tío paterno recibía diálisis por causa que ella ni sus familiares conocían. Su madre tenía dos hermanos que tenían talasemia menor, y su hermana melliza estaba sana. La paciente tomaba anticonceptivos orales desde hacía 3 años, para tratamiento de irregularidades menstruales. Su medicación durante la internación en el otro hospital incluia: heparina, morfina, ranitidina, albuterol, y solución fisioglucosada.
En su internación en este hospital su temperatura era de 38,3ºC, el pulso de 148 por minuto, la TA de 138/72 mmHg, la frecuencia respiratoria de 34 por minuto, y la saturación de oxígeno de 92% mientras la paciente respiraba aire ambiente. Se auscultaba un 2º ruido fuerte. La columna venosa yugular, medidas con la paciente reclinada a 30º era de 7 cm por encima del ángulo esternal. Se palpaba el latido de la pulmonar, y del ventrículo derecho, y se auscultaba un soplo sistólico rudo grado 2/6 en el borde esternal izquierdo. Había dolor en el hemiabdomen derecho, y edema 1+ en ambos miembros inferiores hasta las rodillas.
Un ECG reveló una onda S en derivación D1 y una ond Q y ondas T negativas en D3. Los resultados de laboratorio se muestran en la Tabla 1.

Se tomó una decisión de manejo
Manejo del embolismo pulmonar:
Dr. T. Bernard Kinane: Puedo ver los estudios radiológicos de la paciente?
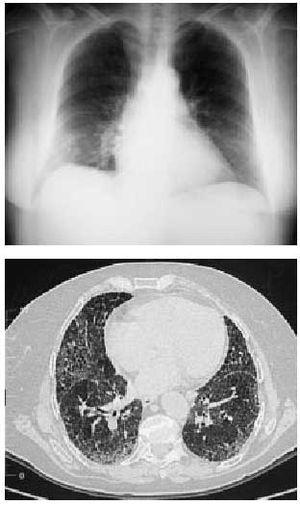
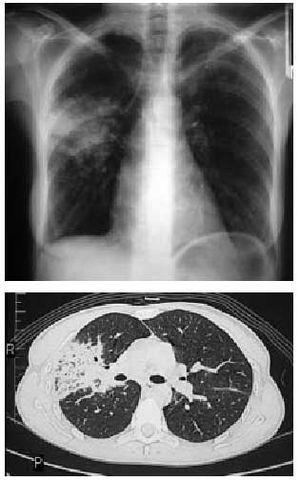
Dr. Katherine Nimkin: La Rx de tórax obtenida en otro hospital revela una opacidad vaga en el ángulo costo-frénico izquierdo. El resto de los pulmones se ven claros. El tamaño cardíaco es normal y no se ve derrame pleural. Las imágenes de la angio-TAC de tórax llevada a cabo antes de que el paciente sea derivado a este hospital, muestra grandes trombos en las ramas derecha e izquierdas de la arteria pulmonar (Figura 1A y 1B), con extensión de los trombos a las arterias pulmonares segmentarias bilateralmente (Figura 1C). La TAC con ventana pulmonar del mismo estudio muestra múltiples opacidades periféricas en forma de cuña en ambos pulmones y pequeños derrames pleurales bilaterales. Una reconstrucción coronal revella, otra vez, opacidades periféricas, consistentes con infartos pulmonares. (Figura 1D).
los trombos a las arterias pulmonares segmentarias bilateralmente (Figura 1C). La TAC con ventana pulmonar del mismo estudio muestra múltiples opacidades periféricas en forma de cuña en ambos pulmones y pequeños derrames pleurales bilaterales. Una reconstrucción coronal revella, otra vez, opacidades periféricas, consistentes con infartos pulmonares. (Figura 1D).
Dr. Katherine Nimkin: La Rx de tórax obtenida en otro hospital revela una opacidad vaga en el ángulo costo-frénico izquierdo. El resto de los pulmones se ven claros. El tamaño cardíaco es normal y no se ve derrame pleural. Las imágenes de la angio-TAC de tórax llevada a cabo antes de que el paciente sea derivado a este hospital, muestra grandes trombos en las ramas derecha e izquierdas de la arteria pulmonar (Figura 1A y 1B), con extensión de
 los trombos a las arterias pulmonares segmentarias bilateralmente (Figura 1C). La TAC con ventana pulmonar del mismo estudio muestra múltiples opacidades periféricas en forma de cuña en ambos pulmones y pequeños derrames pleurales bilaterales. Una reconstrucción coronal revella, otra vez, opacidades periféricas, consistentes con infartos pulmonares. (Figura 1D).
los trombos a las arterias pulmonares segmentarias bilateralmente (Figura 1C). La TAC con ventana pulmonar del mismo estudio muestra múltiples opacidades periféricas en forma de cuña en ambos pulmones y pequeños derrames pleurales bilaterales. Una reconstrucción coronal revella, otra vez, opacidades periféricas, consistentes con infartos pulmonares. (Figura 1D).
Dr. Kinane: La primer pregunta que necesitamos contestarnos en el manejo inmediato de la enfermedad de esta joven paciente con grandes embolias pulmonares, es si debe recibir terapia trombolítica, o un filtro en la vena cava inferior, además del tratamiento con anticoagulación standard. Un segundo punto, es la presencia de síndrome nefrótico, y si este, puede afectar nuestras decisiones terapéuticas. Finalmente, como debe ser manejada su enfermedad renal?
Yo discutiré el uso de trombolisis; El Dr Grabowski discutirá la trombolisis y el tratamiento de anticoagulación, y el Dr Sharma discutirá el manejo de la enfremedad renal.
Yo discutiré el uso de trombolisis; El Dr Grabowski discutirá la trombolisis y el tratamiento de anticoagulación, y el Dr Sharma discutirá el manejo de la enfremedad renal.
El embolismo pulmonar es raro en niños menores de 15 años de edad, (1,2) con una incidencia anual estimada de 0,2 casos por 100.000 niños, comparada con alrededor de 700 casos por 100.000 pacientes de 85 años de edad o mayores. (2,3) Por lo tanto, los datos para el manejo de niños son limitados. Un número de pequeños estudios concluyen que el riesgo de muerte en niños y adultos jóvenes puede ser tan alto como 18%, pero no es tan alto como en los pacientes mayores. (3,4,5)
Terapia trombolítica para el embolismo pulmonar:
La heparina es el tratamiento standard para grandes embolismos pulmonares. La pregunta más importante, es, si la terapia trombolítica agrega beneficios para el paciente. Esta paciente tenía una presión elevada en la arteria pulmonar, que sugirió que había tenido una gran embolia. La disfunción ventricular derecha es el evento crítico en determinar el pronóstico la evolución en casos como este. (4) La tasa de mortalidad es menos de 1% cuando no hay deterioro de la función ventricular derecha, pero puede ser tan alta como 24% en pacientes con disfunción ventricular derecha. (5,6,7) Si esta condición se acompaña de hipotensión arterial sistémica, hay una tasa de mortalidad asociada de 15%, comparada con una tasa de mortalidad de 8% cuando la hipotensión está ausente. (4)
Esta paciente tuvo una disfunción ventricular derecha sustancial, como está demostrado por la elevación de la presión venosa yugular, latido ventricular derecho, niveles muy elevados de péptido natriurético cerebral, y los hallazgos ecocardiográficos de moderada dilatación ventricular derecha, hipertensión pulmonar (60 mmHg), y aplanamiento con movimiento paradojal del septum. Sin embargo, ella no tenía hipotensión arterial, por lo que yo creo que en el momento de presentación, el riesgo estimado de muerte era de 8%.
Puede, la evolución del cuadro de esta paciente ser afectado por el uso de trombolíticos? La mayoría de los estudios indican que los trombolíticos no afectan el riesgo de muerte, (8) pero pueden mejorar la función ventricular derecha en los primeros 3 días de tratamiento. (9) Este beneficio necesita ser cuidadosamente contrapesado contra un 3% de riesgo de hemorragia clínicamente significativa. Aunque tales riesgos son principalmente vistos en pacientes mayores, hay un número de reportes de hemorragias serias en niños.(4) Así, yo concluí en que los beneficios de una terapia trombolítica podría ser marginal, considerando el pequeño riesgo de hemorragia severa.
En suma, sugeriría una terapia de soporte, usando anticoagulación con heparina, en lugar de terapia trombolítica para esta paciente.
Puede, la evolución del cuadro de esta paciente ser afectado por el uso de trombolíticos? La mayoría de los estudios indican que los trombolíticos no afectan el riesgo de muerte, (8) pero pueden mejorar la función ventricular derecha en los primeros 3 días de tratamiento. (9) Este beneficio necesita ser cuidadosamente contrapesado contra un 3% de riesgo de hemorragia clínicamente significativa. Aunque tales riesgos son principalmente vistos en pacientes mayores, hay un número de reportes de hemorragias serias en niños.(4) Así, yo concluí en que los beneficios de una terapia trombolítica podría ser marginal, considerando el pequeño riesgo de hemorragia severa.
En suma, sugeriría una terapia de soporte, usando anticoagulación con heparina, en lugar de terapia trombolítica para esta paciente.
Dr. Nancy Lee Harris (Patología): Dr. Harris, podría darnos su impresión de cuando la paciente entró a la unidad de cuidados intensivos, y como se manejó la situación inicialmente?
Dr. Scott Harris (Terapista): Dado que ni el riesgo de muerte ni la resolución del coágulo se ven afectados poe la trombolisis, yo sólo uso trombolíticos cuando el paciente está en shock. Al momento de ser admitida a la unidad de cuidados intensivos, esta paciente tenía la presión arterial normal, pero tenía taquicardia, con evidencias de sobrecarga de presión del corazón derecho en el ecocardiograma, y también demostrado por un elevado nivel sérico del fragmento N-terminal del péptido natriurético tipo B. Además, el nivel de troponina estaba elevado, y la posibilidad de un coágulo en la vena cava inferior era elevado, de acuerdo a los hallazgos del ecocardiograma. Dado que la administración de más sustancia de contraste podría haber resultado en un fallo renal, nuestras opciones para un diagnóstico rápido de la presencia de un trombo en la vena cava inferior estaban limitados. Yo estaba preocupado por la posibilidad de una nueva embolia pulmonar agregada, que, dado la sobrecarga de presión del corazón derecho pudiera ser fatal. Yo consideré los beneficios de la rápida disolución de los trombos usando trombolíticos y lo contrapesé contra el riesgo de sangrado. De haber estado seguro de que no había más coágulos en la vena cava inferior, yo hubiera optado por anticoagulación sola.
Cinco horas después de la internación, la administración de heparina intravenosa fue discontinuada y se llevó a cabo trombolisis con 100 mg de activador tisular del plasminógeno (tPA) en el curso de 2 horas. Afortunadamente, la paciente no tuvo complicaciones hemorrágicas. La anticoagulación con heparina no fraccionada a un ritmo de 1100 U por hora fue recomenzada. En las siguientes 24 horas, la frecuencia cardíaca permaneció entre 135 y 150 latidos por minuto, la presión arterial sistólica era de 130 a 150 mm Hg, y requerió 3 litros de oxígeno administrados por cánula nasal para mantener una saturación de oxígeno de entre 97% y 100%.
Cinco horas después de la internación, la administración de heparina intravenosa fue discontinuada y se llevó a cabo trombolisis con 100 mg de activador tisular del plasminógeno (tPA) en el curso de 2 horas. Afortunadamente, la paciente no tuvo complicaciones hemorrágicas. La anticoagulación con heparina no fraccionada a un ritmo de 1100 U por hora fue recomenzada. En las siguientes 24 horas, la frecuencia cardíaca permaneció entre 135 y 150 latidos por minuto, la presión arterial sistólica era de 130 a 150 mm Hg, y requerió 3 litros de oxígeno administrados por cánula nasal para mantener una saturación de oxígeno de entre 97% y 100%.
Dr. Kinane: Puedo ver el seguimiento ecocardiográfico, y los estudios radiológicos?
Dr. Mary Etta King: Seis horas y media después de la trombolisis, se obtuvo un nuevo ecocardiograma. Los hallazgos son similares a los reportados por el ecocardiograma realizado antes en otra institución. Una vista de un eje largo paraesternal del corazón izquierdo muestra engrosamiento de la pared libre ventricular izquierda y un pequeño derrame pericárdico posterior. Un corte del ventrículo derecho muestra el septum interventricular completamente aplanado en sístole indicando sobrecarga de presión del ventrículo derecho ( Figura 2A). Una visión apical en cuatro cámaras (12) muestra el clásico hallazgo de sobrecarga de presión del corazón derecho (signo de McConnell) que ha sido descripto en pacientes con embolia pulmonar aguda, y que consiste en una contractilidad diferente en distintos sectores, expresada por una pobre contractilidad de la base y la parte media del ventrículo derecho contrastando con una movilidad normal del apex ventricular derecho.
Figura 2A). Una visión apical en cuatro cámaras (12) muestra el clásico hallazgo de sobrecarga de presión del corazón derecho (signo de McConnell) que ha sido descripto en pacientes con embolia pulmonar aguda, y que consiste en una contractilidad diferente en distintos sectores, expresada por una pobre contractilidad de la base y la parte media del ventrículo derecho contrastando con una movilidad normal del apex ventricular derecho.
Las imágenes subcostales revelan pobre contractilidad del ventrículo derecho con un engrosamiento de la pared libre del ventrículo derecho, sugiriendo que la sobrecarga aguda de presión del corazón derecho puede haberse injertado en un proceso más subagudo o crónico que condujo a hipertrofia ventricular derecha.
 Figura 2A). Una visión apical en cuatro cámaras (12) muestra el clásico hallazgo de sobrecarga de presión del corazón derecho (signo de McConnell) que ha sido descripto en pacientes con embolia pulmonar aguda, y que consiste en una contractilidad diferente en distintos sectores, expresada por una pobre contractilidad de la base y la parte media del ventrículo derecho contrastando con una movilidad normal del apex ventricular derecho.
Figura 2A). Una visión apical en cuatro cámaras (12) muestra el clásico hallazgo de sobrecarga de presión del corazón derecho (signo de McConnell) que ha sido descripto en pacientes con embolia pulmonar aguda, y que consiste en una contractilidad diferente en distintos sectores, expresada por una pobre contractilidad de la base y la parte media del ventrículo derecho contrastando con una movilidad normal del apex ventricular derecho.Las imágenes subcostales revelan pobre contractilidad del ventrículo derecho con un engrosamiento de la pared libre del ventrículo derecho, sugiriendo que la sobrecarga aguda de presión del corazón derecho puede haberse injertado en un proceso más subagudo o crónico que condujo a hipertrofia ventricular derecha.
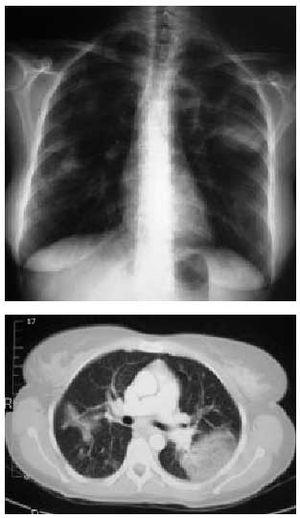
Dr. Nimkin: La TAC de tórax y abdomen con la administración de contraste oral e intravenoso fue llevada a cabo el segundo día de internación. No se vieron trombos en pelvis ni en miembros inferiores. Se obtuvieron nefrogramas estriados bilateralmente, hallazgo asociado a trombosis de las venas renales; se vieron trombos intraluminales en ambas venas renales. Las imágenes del corazón, en el mismo estudio demostraron una relación de más de 1.0 cuando se comparó el diámetro del ventrículo derecho con el del ventrículo izquierdo, un hallazgo asociado con una disfunción ventricular derecha significativa en el contexto de tromboembolismo pulmonar. (13) El seguimiento con Rx de tórax llevado a cabo 2 días más tarde mostró progresión de las opacidades bibasales y derrame pleural moderado bilateral.
Las imágenes de venografía por RMN obtenidas en el 4º día de hospital y las vistas axiales de una angiografía bidimensional llevada a cabo sin material de contraste mostraron la permeabilidad de las venas pélvicas y de la porción inferior de la vena cava; la pobre visualización de la vena renal izquierd a es probablemente debida a trombo. (Figura 3)
a es probablemente debida a trombo. (Figura 3)
Las imágenes de venografía por RMN obtenidas en el 4º día de hospital y las vistas axiales de una angiografía bidimensional llevada a cabo sin material de contraste mostraron la permeabilidad de las venas pélvicas y de la porción inferior de la vena cava; la pobre visualización de la vena renal izquierd
 a es probablemente debida a trombo. (Figura 3)
a es probablemente debida a trombo. (Figura 3)
Dr. Kinane: Nosotros no consideramos la colocación de un filtro en la vena cava inferior en esta paciente ya que no había evidencias de coágulos en la vena cava inferior.
Trombolisis y anticoagulación en el embolismo pulmonar
Dr. Eric F. Grabowski: El approach para trombolisis para el embolismo pulmonar masivo es una alta dosis de activador tisular del plasminógeno (tPA) 100 mg administrados en el término de 2 horas. (8,9,10,11)
Aunque yo sostuve el uso de en tPA este caso, el uso de altas dosis de este agente se asocia a un riesgo mayor de 1 a 3% de hemorragia intracraneal. Hay pocos reportes de uso efectivo de bajas dosis de tPA en pacientes pediátricos con trombosis venosa profunda (0,03 mg/kg de peso por hora durante 2 o 3 días), junto con bajas dosis de heparina no fraccionada, (14,15,16,17,18,19,20) sin eventos hemorrágicos mayores. (19) Uno se asombra si, en el contexto de un ensayo clínico, este approach a bajas dosis pueda ser efectivo, a la vez que seguro en niños con embolismo pulmonar que tienen disfunción ventricular derecha pero que no están en shock. Esos datos no deben ser considerados como directivas clínicas; sin embargo, nosotros esperamos ensayos en gran escala que puedan clarificar el potencial clínico de este approach.
Trombolisis y anticoagulación en el embolismo pulmonar
Dr. Eric F. Grabowski: El approach para trombolisis para el embolismo pulmonar masivo es una alta dosis de activador tisular del plasminógeno (tPA) 100 mg administrados en el término de 2 horas. (8,9,10,11)
Aunque yo sostuve el uso de en tPA este caso, el uso de altas dosis de este agente se asocia a un riesgo mayor de 1 a 3% de hemorragia intracraneal. Hay pocos reportes de uso efectivo de bajas dosis de tPA en pacientes pediátricos con trombosis venosa profunda (0,03 mg/kg de peso por hora durante 2 o 3 días), junto con bajas dosis de heparina no fraccionada, (14,15,16,17,18,19,20) sin eventos hemorrágicos mayores. (19) Uno se asombra si, en el contexto de un ensayo clínico, este approach a bajas dosis pueda ser efectivo, a la vez que seguro en niños con embolismo pulmonar que tienen disfunción ventricular derecha pero que no están en shock. Esos datos no deben ser considerados como directivas clínicas; sin embargo, nosotros esperamos ensayos en gran escala que puedan clarificar el potencial clínico de este approach.
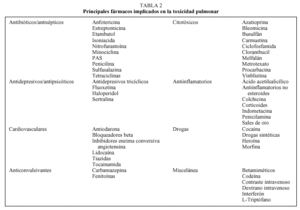
Factores de riesgo para embolismo pulmonar.
En esta paciente, fue importante buscar factores de riesgo congénitos y adquiridos para embolismo pulmonar para determinar el riesgo de recurrencia y la necesaria duración de la terapia con anticoagulación, e identificar y tratar las condiciones potencialmente reversibles. La paciente tiene un síndrome nefrótico, que induce un estado hipercoagulable. (21) En el síndrome nefrótico, los eventos tromboembólicos son menos frecuentes en niños que en adultos, habiendo ocurrido en 5% de los niños y en 44% de los adultos en un estudio. (21) Los mecanismos de la hipercoagulabilidad en el síndrome nefrótico (21) incluyen bajos niveles de proteína S, debido a clearence disminuído de proteína unida a C4, que se une a la proteína S, y a un clearence renal aumentado de la protína S libre; aumento de los niveles de factores V, VII, VIII, factor de von Willebrand, y fibrinógeno; una lipoproteina Lp(a) aumentada. Un aumento de la producción de lipoproteína Lp(a) por el hígado es acompañada por la pérdida de otras proteínas producidas por el hígado.
Nuestra paciente tenía niveles elevados de lipoproteína Lp(a) (Tabla 1). Los pacientes con síndrome nefrótico tienen los niveles más altos descriptos de Lp(a) (22) y esos niveles elevados le confieren un riesgo de tromboembolismo venoso que es tres veces mayor que el normal. (23)La lipoproteína Lp(a) compite con el plasminógeno por los sitios de unión endotelial de este, se une e inhibe la vía del inhibidor del factor tisular, y transporta colesterol a la pared de los vasos. Los niveles promedio son mayores en negros que en blancos, este es un punto relevante ya que nuestra paciente es negra.
Esta paciente tiene otros factores de riesgo para embolismo pulmonar, incluyendo edema en miembros inferiores debidos a hipoalbuminemia asociada a síndrome nefrótico, inmovilidad prolongada debido al dolor lumbar y abdominal que presentó, lo cual puede resultar en estasis venosa secundaria, a lo que se agrega el uso de anticonceptivos. Otros factores de riesgo (Tabla 1) incluyendo niveles levemente bajos de antitrombina III (AT-III), probablemente debido a la administración de heparina, y al aumento del clearence renal de la antitrombina III,y a un elevado nivel de IgM anticardiolipina, que volvió a lo normal días después del primer testeo. Un test para anticoagulante lúpico fue negativo. Los resultados de los tests funcionales para proteína C y S fueron normales, y un test para resistencia a la proteína C activada fue negativo, indicando que la mutación del factor V de Leyden no era la causa del cuadro clínico de esta paciente. La historia familiar era negativa para stroke, infarto agudo de miocardio, trombosis venosa profunda, embolismo pulmonar en menores de 55 años, ni tampoco tenía parientes en primer grado que hubiesen presentado abortos espontáneos.
Esta paciente tiene otros factores de riesgo para embolismo pulmonar, incluyendo edema en miembros inferiores debidos a hipoalbuminemia asociada a síndrome nefrótico, inmovilidad prolongada debido al dolor lumbar y abdominal que presentó, lo cual puede resultar en estasis venosa secundaria, a lo que se agrega el uso de anticonceptivos. Otros factores de riesgo (Tabla 1) incluyendo niveles levemente bajos de antitrombina III (AT-III), probablemente debido a la administración de heparina, y al aumento del clearence renal de la antitrombina III,y a un elevado nivel de IgM anticardiolipina, que volvió a lo normal días después del primer testeo. Un test para anticoagulante lúpico fue negativo. Los resultados de los tests funcionales para proteína C y S fueron normales, y un test para resistencia a la proteína C activada fue negativo, indicando que la mutación del factor V de Leyden no era la causa del cuadro clínico de esta paciente. La historia familiar era negativa para stroke, infarto agudo de miocardio, trombosis venosa profunda, embolismo pulmonar en menores de 55 años, ni tampoco tenía parientes en primer grado que hubiesen presentado abortos espontáneos.
Anticoagulación en el síndrome nefrótico
La hipoalbuminemia en esta paciente tiene la potencialidad de hacer que la ventana terapéutica de la heparina no-fraccionada sea inexistente, ya que la heparina se une normalmente en 80% a 90% a las proteínas. Por lo tanto, en este caso, yo consideraría usar argatroban, un inhibidor directo de la trombina, el cual se une solo 55% a las proteínas pasmáticas y tiene un metabolismo hepático en vez de renal. Después de 48 hs de la infusión de heparina, se consiguió un tiempo parcial de tromboplastina de 60 a 84 segundos. El tratamiento de la paciente fue cambiado a warfarina con un RIN de 2 a 3.
La siguiente pregunta es, por cuanto tiempo debemos continuar con tratamiento anticoagulante en esta paciente? Esta decisión está influida por la presencia y el tipo de los factores de riesgo. El riesgo de tromboembolismo recurrente después de un embolismo pulmonar resultante de un evento precipitante, tal como el uso de anticonceptivos y síndrome nefrótico (como en este caso), es menor que el de un paciente sin riesgo aparente o con un factor de riesgo fijo, tal como un estado hipercoagulable congénito. (24,25) Aunque carecemos de datos de tratamiento en adolescentes, yo recomendé continuar con warfarina a un RIN de 2 a 3 por 1 año desde el diagnóstico de embolismo pulmonar, y después 6 a 12 meses con un RIN de 1,5 a 2, con un plan de suspender la anticoagulación si los niveles de lipoproteína Lp(a) puede ser corregido y el síndrome nefrótico controlado.
La siguiente pregunta es, por cuanto tiempo debemos continuar con tratamiento anticoagulante en esta paciente? Esta decisión está influida por la presencia y el tipo de los factores de riesgo. El riesgo de tromboembolismo recurrente después de un embolismo pulmonar resultante de un evento precipitante, tal como el uso de anticonceptivos y síndrome nefrótico (como en este caso), es menor que el de un paciente sin riesgo aparente o con un factor de riesgo fijo, tal como un estado hipercoagulable congénito. (24,25) Aunque carecemos de datos de tratamiento en adolescentes, yo recomendé continuar con warfarina a un RIN de 2 a 3 por 1 año desde el diagnóstico de embolismo pulmonar, y después 6 a 12 meses con un RIN de 1,5 a 2, con un plan de suspender la anticoagulación si los niveles de lipoproteína Lp(a) puede ser corregido y el síndrome nefrótico controlado.
Dr. Charles A. Hales (Neumonología): Yo sospecho que la trombolisis en esta paciente estaba justificada, no tanto como una medida para salvar su vida, sino mas bien como tratamiento a largo plazo de su hipertensión pulmonar tromboembólica. La terapia con bajas dosis de activador tisular del plasminógeno debe solo ser usado en el contexto de un ensayo clínico.
Dr. Nancy Lee Harris: Dr. Fracchia, puede usted decirnos como fue el curso de la internación de esta paciente?
Dr. Fracchia: La taquicardia de 120 a 150 latidos por minuto persistieron por 4 días después de la trombolisis. Se comenzó tratamiento con warfarina. El 5º día después de la trombolisis, la taquicardia se resolvió, y la saturación de oxígeno era de 99% mientras la paciente respiraba aire ambiente. La heparina fue discontinuada y fue dada de alta el 9º día, tomando warfarina (6 mg/día), prednisona (30 mg/día), enalapril (10 mg dos veces por día), furosemida (20 mg/día), sulfato ferroso (325 mg/día), y ranitidina (150 mg/día)
Dr. Nancy Lee Harris: Después del alta, como parte de la evaluación por el departamento de nefrología de este hospital, se llevó a cabo una revisión de la biopsia renal en este hospital.
Diagnóstico clínico:
Diagnóstico clínico:
Embolismo pulmonar en el contexto de síndrome nefrótico.
Discusión patológica:
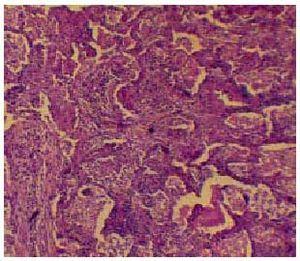
Dr. Lynn D. Cornell: Una muestra de la biopsia renal obtenida en otro hospital fue revisada en este hospital, 6 días después del alta de la paciente. La misma contenía 8 glomérulos, ninguno de los cuales estaba globalmente esclerótico. Había pocas áreas de hipercelularidad mesangial (Figura 4A). Las membranas basales glomerulares parecían tener un espesor normal, excepto por ocasionales asas capilares que mostraban leve engrosamiento. Se vieron depósitos en las membranas basales glomerulares y en el mesangio con una tinción con tricrómico. No había semilunas, hipercelularidad endocapilar, restos cariorrécticos, o depósitos en asa de alambre en los glomérulos. No había evidencias de trombosis, vasculitis, inflamación intersticial, o fibrosis. Las células epiteliales tubulares contenían gotas de reabsorción, indicativas de proteinuria. La microscopía con inmunofluorescencia (Figura 4B) reveló depósitos brillantes en la membrana basal glomerular y en el mesangio, de IgG, y C3, y tenues depósitos de IgM e IgA. La tinción para C1q fue ne gativa. La microscopía electrónica mostró (Figuras 4C y 4D) , numerosos depósitos subepiteliales electrón-densos, acompañados por fusión de los pies de los podocitos con hipertrofia vellosa de los podocitos. Además, había ocasionales depósitos subendoteliales, algunos de apariencia linear, a lo largo de las membranas basales, y muchos depósitos electrón-densos. Estos hallazgos son diagnósticos de glomerulonefritis membranosa.
gativa. La microscopía electrónica mostró (Figuras 4C y 4D) , numerosos depósitos subepiteliales electrón-densos, acompañados por fusión de los pies de los podocitos con hipertrofia vellosa de los podocitos. Además, había ocasionales depósitos subendoteliales, algunos de apariencia linear, a lo largo de las membranas basales, y muchos depósitos electrón-densos. Estos hallazgos son diagnósticos de glomerulonefritis membranosa.
 gativa. La microscopía electrónica mostró (Figuras 4C y 4D) , numerosos depósitos subepiteliales electrón-densos, acompañados por fusión de los pies de los podocitos con hipertrofia vellosa de los podocitos. Además, había ocasionales depósitos subendoteliales, algunos de apariencia linear, a lo largo de las membranas basales, y muchos depósitos electrón-densos. Estos hallazgos son diagnósticos de glomerulonefritis membranosa.
gativa. La microscopía electrónica mostró (Figuras 4C y 4D) , numerosos depósitos subepiteliales electrón-densos, acompañados por fusión de los pies de los podocitos con hipertrofia vellosa de los podocitos. Además, había ocasionales depósitos subendoteliales, algunos de apariencia linear, a lo largo de las membranas basales, y muchos depósitos electrón-densos. Estos hallazgos son diagnósticos de glomerulonefritis membranosa.La glomerulonefritis membranosa es un diagnóstico patológico caracterizado por depósitos inmunes subepiteliales en la membrana basal glomerular. Esta puede ser una enfermedad primaria (idiopática), o puede ser secundaria a un número de condiciones: drogas, cáncer, infección, o enfermedades autoinmunes, más comunmente lupus eritematoso sistémico, en el que se clasifica como nefropatía lúpica clase V. Hay varios hallazgos en este caso, que sugieren que esta glomerulonefritis membranosa es secundaria a lupus eritematoso sistémico, incluyendo los depósitos mesangiales, los depósitos subendoteliales y los depósitos de IgA revelados por la inmunofluorescencia. (Tabl
 a 2) Además, aunque los tests para FAN fueron negativos en la presentación inicial de la enfermedad renal, ella tuvo un resultado de FAN positivos en su internación. Aunque no todos los hallazgos de glomerulonefritis lúpica estaban presentes en esta biopsia, la mayoría de los casos no muestran todos los hallazgos.
a 2) Además, aunque los tests para FAN fueron negativos en la presentación inicial de la enfermedad renal, ella tuvo un resultado de FAN positivos en su internación. Aunque no todos los hallazgos de glomerulonefritis lúpica estaban presentes en esta biopsia, la mayoría de los casos no muestran todos los hallazgos.
La enfermedad renal de cualquier clase de nefritis lúpica puede preceder al diagnóstico de lupus eritematoso sistémico, en algunos meses o aún años. En particular, en pacientes con clase V (membranosa) de nefropatía lúpica, es probable que la enfermedad se presente con afectación exclusivamente renal. (15)
En resumen, la biopsia de esta paciente reveló hallazgos de glomerulonefritis membranosa secundaria. Si es secundaria a lupus, solo el tiempo lo dirá.
Manejo de la glomerulonefritis membranosa
Dr. Amita Sharma: En esta paciente, la distinción entre una glomerulonefritis membranosa idiopática y una secundaria es difícil de realizar. La glomerulonefritis membranosa lúpica se caracteriza predominantemente por síndrome nefrótico, como se vió en este caso, así como hipertensión variable; la hipocomplementemia, el fallo renal, y los anticuerpos anti DNA de doble cadena pueden estar ausentes, como lo estaban en esta paciente. Como los criterios necesarios para el diagnóstico definitivo de lupus no estuvieron presentes durante la internación, debimos considerar a la enfermedad como idiopática.
La glomerulonefritis membranosa idiopática es una causa infrecuente de síndrome nefrótico en niños, y el curso, y el tratamiento más apropiado, no está definido. (16) Ya que un tercio de los niños con esta enfermedad pueden tener remisiones espontáneas, (28) los beneficios de una terapia temprana deben ser contrapesados con los efectos colaterales del tratamiento en una paciente joven. El objetivo de la terapia es disminuir el tiempo de la fase nefrótica, disminuyendo así el riesgo de enfermedad tromboembólica, y de enfermedad vascular aterosclerótica prematura, y finalmente preservar lo mejor posible la función renal. (29) Nosotros utilizamos la cuantificación de la proteinuria, la función renal en la presentación, y los cambios que van ocurriendo en estas variables en los 6 meses iniciales para evaluar el éxito del tratamiento. (30)
El tratamiento de primera línea está dirigido a mejorar la proteinuria y tratar la hiperlipidemia, la hipertensión, y otros problemas asociados. Los inhibidores de la enzima convertidora de angiotensina (IECA), los antagonistas del receptor de angiotensina, protegen al riñón, posiblemente por reducir la proteinuria y prevenir la cicatrización intersticial por el tráfico tubular de proteínas, (31) y los agentes reductores de lípidos, tal como las estatinas reducen el riesgo de complicaciones trombóticas y enfermedad vascular aterosclerótica. Esta paciente fue incapaz de tolerar las estatina, y a pesar del tratamiento con enalapril, y un inhibidor del receptor de angiotensina, la excreción de proteínas urinarias continuó siendo de 10 gr/día y hubo complicaciones tromboembólicas.
La glomerulonefritis membranosa idiopática es una causa infrecuente de síndrome nefrótico en niños, y el curso, y el tratamiento más apropiado, no está definido. (16) Ya que un tercio de los niños con esta enfermedad pueden tener remisiones espontáneas, (28) los beneficios de una terapia temprana deben ser contrapesados con los efectos colaterales del tratamiento en una paciente joven. El objetivo de la terapia es disminuir el tiempo de la fase nefrótica, disminuyendo así el riesgo de enfermedad tromboembólica, y de enfermedad vascular aterosclerótica prematura, y finalmente preservar lo mejor posible la función renal. (29) Nosotros utilizamos la cuantificación de la proteinuria, la función renal en la presentación, y los cambios que van ocurriendo en estas variables en los 6 meses iniciales para evaluar el éxito del tratamiento. (30)
El tratamiento de primera línea está dirigido a mejorar la proteinuria y tratar la hiperlipidemia, la hipertensión, y otros problemas asociados. Los inhibidores de la enzima convertidora de angiotensina (IECA), los antagonistas del receptor de angiotensina, protegen al riñón, posiblemente por reducir la proteinuria y prevenir la cicatrización intersticial por el tráfico tubular de proteínas, (31) y los agentes reductores de lípidos, tal como las estatinas reducen el riesgo de complicaciones trombóticas y enfermedad vascular aterosclerótica. Esta paciente fue incapaz de tolerar las estatina, y a pesar del tratamiento con enalapril, y un inhibidor del receptor de angiotensina, la excreción de proteínas urinarias continuó siendo de 10 gr/día y hubo complicaciones tromboembólicas.
Si la proteinuria persiste a pesar del tratamiento mencionado, o agrega insuficiencia renal, o ambas cosas, como pasó en este caso se agregan inmunosupresores. (32,33,34) La monoterapia standard con corticosteroides es a menudo inefectiva. (35) En este hospital iniciamos tratamiento con corticosteroides y después del alta agregamos losartan, un bloqueador del receptor de angiotensina; sin embargo, el nivel de proteínas urinarias continuó siendo de 8 gr/día . El micofenolato mofetil ha sido usado tanto en glomerulonefritis membranosa idiopática y en la secundaria a lupus, (32,35) y fue agregado a la medicación de la paciente 3 meses después del alta.
El nivel de albúmina sérica volvió a lo normal y la excreción de proteínas urinarias disminuyó a menos de 1 gr/día a los 6 meses del alta. Ocho meses después del alta, desarrolló condilomas acuminados genitales, y allí nos enteramos de que varios años antes se había hecho diagnóstico de infección por paiplomavirus humano. La dosis de micofenolato mofetil fue reducido con lo que los condilomas se resolvieron, y la función renal permaneció normal. La dosis de micofenolato se siguió bajando hasta suspenderla aproximadamente 15 meses después del alta; la prednisona fue suspendida aproximadamente 20 meses después del alta.
El nivel de complemento continúa siendo normal; ella continúa con un FAN positivo en títulos de 1/160 con un patrón moteado, y un test negativo para anti DNA de doble cadena; no hay evidencias clínicas de lupus eritematoso sistémico, y la excreción urinaria de proteínas es de 0,2 g/día.
Dr. Nancy Lee Harris: Cuando cree que ocurrió el embolismo pulmonar, y, debe esta condición haber influenciado la decisión de someterla a trombolisis?
Dr. Kinane: Yo sospecho que ella había tenido una embolia pulmonar durante 6 semanas.
Si la paciente hubiese seguido presentando eventos embólicos a pesar de la anticoagulación, nosotros hubiésemos considerado la colocación de un filtro en la vena cava inferior. Yo vi a esta paciente por última vez, 18 meses después del alta, ella estaba bien y físicamente activa, y en buen estado atlético. Los tests de función pulmonar estaban normales.
Dr. Nancy Lee Harris:Como continuó la paciente con los anticoagulantes?
Dr. Grabowski: Nosotros discontinuamos la warfarina después de 14 meses, ya que el síndrome nefrótico estaba bien controlado, su Lp(a) normalizada (23) y no había tromboembolismo recurrente.
Diagnóstico anatómico:
Glomerulonefritis membranosa con síndrome nefrótico y embolia pulmonar.
Traducción de
A 17-Year-Old Girl with Chest Pain and Hemoptysis
Case records of the Massachusetts General Hospital
Febrero 28/2008
Fuente
From the Departments of Pediatrics (T.B.K., E.F.G., A.S., M.E.K.), Radiology (K.N.), and Pathology (L.D.C.), Massachusetts General Hospital; and the Departments of Pediatrics (T.B.K., E.F.G., A.S., M.E.K.), Radiology (K.N.), and Pathology (L.D.C.), Harvard Medical School.
A 17-Year-Old Girl with Chest Pain and Hemoptysis
Case records of the Massachusetts General Hospital
Febrero 28/2008
Fuente
From the Departments of Pediatrics (T.B.K., E.F.G., A.S., M.E.K.), Radiology (K.N.), and Pathology (L.D.C.), Massachusetts General Hospital; and the Departments of Pediatrics (T.B.K., E.F.G., A.S., M.E.K.), Radiology (K.N.), and Pathology (L.D.C.), Harvard Medical School.