Etiología de los abscesos pulmonares
Aspiración de secreciones bucales (más frecuente)
Obstrucción endobronquial
Siembra hematógena de los pulmones (menos frecuente)
La mayoría de los abscesos pulmonares aparecen después de la aspiración de secreciones bucales en pacientes con gingivitis o mala higiene bucal. En general, los pacientes tienen alteraciones de la consciencia como consecuencia de la intoxicación por alcohol, drogas recreativas, anestesia, sedantes u opiáceos. También están en riesgo los pacientes de edad avanzada y aquellos que no pueden manejar sus secreciones bucales, a menudo debido a una enfermedad neurológica.
Los abscesos pulmonares también pueden desarrollarse como resultado de la obstrucción endobronquial (p. ej., debido a un carcinoma bronquial) o la inmunosupresión (p. ej., debido al HIV/sida o después del trasplante y el uso de fármacos inmunosupresores).
Una causa menos común de absceso pulmonar es la neumonía necrosante que puede desarrollarse a partir de la siembra hematógena de los pulmones debido a una tromboembolia supurativa (p. ej., embolia séptica debido al uso de fármacos intravenosos o síndrome de Lemierre) o endocarditis del lado derecho. A diferencia de la aspiración y la obstrucción, estas enfermedades suelen manifestarse en forma aguda y causan abscesos pulmonares múltiples en lugar de aislados.
La infección directa (p. ej., desde un empiema, u absceso subfrénico o mediastínico) en lugar de la siembra hematógena es posible para ciertas bacterias piógenas (p. ej., Staphylococcus aureus).
Patógenos
Los patógenos más comunes de los abscesos pulmonares debidos a la aspiración son las bacterias anaerobias, pero cerca de la mitad de los casos implica a microorganismos aerobios y anaerobios (véase tabla Causas infecciosas de lesiones cavitarias del pulmón).
Los patógenos anaerobios más frecuentes son
Peptostreptococcus
Fusobacterium
Prevotella
Bacteroides
Los patógenos aerobios más frecuentes son
En ocasiones, los casos se deben a bacterias gramnegativas, sobre todo Klebsiella. Los pacientes inmunocomprometidos con absceso pulmonar mayormente están infectados por Pseudomonas aeruginosa u otros bacilos gramnegativos, pero también pueden tener una infección por Nocardia, especies de Mycobacterias u hongos.
Raros casos de gangrena pulmonar (necrosis extensa que compromete un lóbulo o un pulmón) o neumonía fulminante con sepsis han sido informados por patógenos como SARM, Pneumococcus, y Klebsiella. Algunos pacientes están en riesgo de abscesos por Mycobacterium tuberculosis, y algunos casos se deben a una infección amebiana (p. ej., Entamoeba histolytica), quistes hidatídicos, paragonimiasis o infección por Burkholderia pseudomallei.
La introducción de estos patógenos en los pulmones primero causa inflamación, lo que, en el transcurso de una o dos semanas, conduce a la necrosis de los tejidos y, a continuación, a la formación de absceso. Éste suele romperse en un bronquio, su contenido es expectorado y deja una cavidad llena de líquido y aire. En cerca del 10% de los casos, se produce la extensión directa o indirecta (a través de la fístula broncopleural) en la cavidad pleural que puede producir un empiema.
Síntomas y signos de absceso pulmonar
Los síntomas de los abscesos por bacterias anaerobias o bacterias aerobias y anaerobias mixtas suelen ser crónicos (p. ej., presentes durante semanas o meses) e incluyen tos productiva, fiebre, sudores nocturnos y pérdida de peso. Los pacientes también pueden presentar hemoptisis y dolor torácico pleurítico. El esputo puede ser purulento o con estrías de sangre y, clásicamente, tiene olor y sabor desagradables. Los pacientes pueden tener aliento fétido.
Los síntomas de los abscesos debidos a bacterias aerobias tienen una evolución más aguda y se asemejan a los de la neumonía bacteriana. Los abscesos debidos a microorganismos distintos de los anaerobios (p. ej., Mycobacterias, Nocardia) no tienen secreciones respiratorias pútridas y es más probable que se produzcan en las regiones no declive del pulmón.
Los signos del absceso pulmonar, cuando están presentes, son inespecíficos y se parecen a los de la neumonía: disminución de los ruidos respiratorios que indican consolidación o derrame, temperatura ≥ 38° C, crepitantes sobre la zona afectada, egofonía y matidez a la percusión en presencia de derrame. Los pacientes suelen tener signos de enfermedad periodontal y antecedente de una causa predisponente de aspiración, como disfagia o alguna enfermedad que causa problemas de la consciencia.
Diagnóstico de absceso pulmonar
Radiografía de tórax
A menudo, TC de tórax para una mejor visualización o si se sospecha una obstrucción endobronquial
Cultivos de esputo para bacterias aerobias, hongos y micobacterias
Broncoscopia según sea necesario para excluir el cáncer, detectar patógenos inusuales, tales como hongos o micobacterias, y en pacientes inmunodeprimidos
Cultivo de cualquier líquido pleural
El absceso pulmonar se sospecha sobre la base de los antecedentes en un paciente con riesgo elevado (p. ej., mayor predisposición a la aspiración debido a alteración de la consciencia, disfagia o inmunodeficiencia) y se confirma con una radiografía de tórax que muestra cavitación.
Las lesiones pulmonares cavitarias no siempre son causadas por una infección. Las causas no infecciosas de las lesiones pulmonares cavitarias incluyen las siguientes:
Empiema o bulla con nivel hidroaéreo
Bronquiectasias quística (sacular)
Infarto pulmonar
Nódulo de silicosis nodular con necrosis central
Secuestro pulmonar
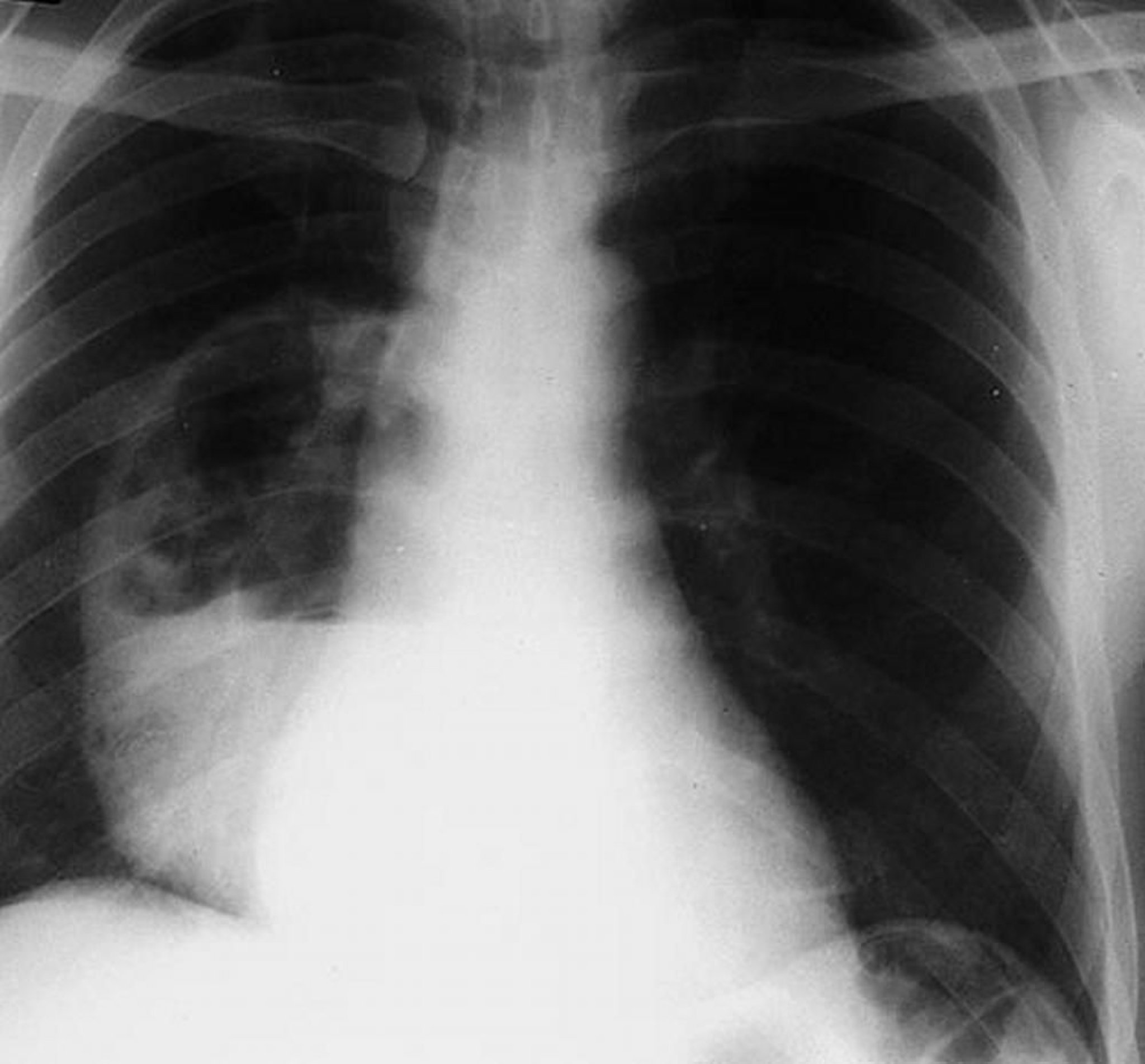
En una infección anaerobia por aspiración, la radiografía de tórax muestra clásicamente consolidación con una única cavidad que contiene un nivel hidroaéreo en las porciones del pulmón que estarían en declive cuando el paciente está recostado (p. ej., los segmentos posteriores de los lóbulos superiores) o los segmentos basales superiores o laterales de los lóbulos inferiores. Este patrón ayuda a distinguir el absceso por anaerobios de otras causas de enfermedad pulmonar cavitaria, porque la enfermedad pulmonar difusa o embólica a menudo causa cavitaciones múltiples y la tuberculosis afecta los vértices.
La TC no se necesita de forma rutinaria (p. ej., si la cavitación es clara en la radiografía de tórax en un paciente que tiene factores de riesgo para absceso pulmonar). Sin embargo, la TC puede ser útil cuando se sugiere la cavitación, pero no se ve claramente en la radiografía de tórax, cuando se sospecha una masa pulmonar subyacente que obstruye el drenaje de un segmento de pulmón, o cuando el absceso debe ser diferenciado de empiema o bulla con nivel hidroaéreo.
Con autorización del editor. De Leaf H. In Atlas of Infectious Diseases: Pleuropulmonary and Bronchial Infections. Publicado por GL Mandell (series editor) y MS Simberkoff. Philadelphia, Current Medicine, 1996.
El carcinoma bronquial puede producir una obstrucción que causa neumonía y formación de absceso. El carcinoma bronquial debe sospecharse en pacientes que no responden al tratamiento antimicrobiano o que tienen resultados atípicos, tales como una lesión cavitaria y sin fiebre. La broncoscopia a veces se realiza para descartar el cáncer o la presencia de un cuerpo extraño o para detectar patógenos inusuales, como hongos o micobacterias. La broncoscopia se realiza si los pacientes están inmunocomprometidos.
Cultivos
Rara vez se identifican bacterias anaerobias en los cultivos porque resulta difícil obtener muestras no contaminadas y porque la mayoría de los laboratorios no realizan bien y con frecuencia los cultivos para anaerobios. Si el esputo es pútrido, se supone que la causa es la infección anaerobia. Sin embargo, si hay empiema, el líquido pleural representa una buena muestra para el cultivo de microorganismos anaerobios.
Cuando los hallazgos clínicos indican que la infección anaerobia es menos probable, debe sospecharse una infección por microorganismos aerobios, hongo o micobacterias, y debe tratarse de identificar el patógeno. Son útiles los cultivos de muestras de esputo o de aspirado broncoscópico.
Tratamiento de los abscesos pulmonares
Antibióticos IV o, en el caso de pacientes menos afectados, antibióticos orales
Drenaje percutáneo, endobronquial o quirúrgico de cualquier absceso que no responda a los antibióticos o de cualquier tipo de empiema
La elección primaria es una combinación de un beta-lactámico con un inhibidor de beta-lactamasa, por ejemplo, ampicilina/sulbactam en dosis de 1,5 g (1 g de ampicilina más 0,5 g de sulbactam) a 3 g (2 g de ampicilina más 1 g de sulbactam) IV o IM cada 6 horas; la dosis no debe exceder los 12 g por día. Alternativas incluyen un carbapenem (p. ej., imipenem/cilastatina 500 mg IV cada 6 horas) o terapia combinada con metronidazol 500 mg cada 8 horas, más penicilina 2 millones de unidades IV cada 6 horas. En los pacientes alérgicos a la penicilina, se consideran opcines alternativas la clindamicina en dosis de 600 mg IV cada 8 horas, la moxifloxacina en dosis de 400 mg 1 vez al día o terapia combinada con levofloxacina en dosis de 750 mg 1 vez al día con metronidazol en dosis de 500 mg cada 8 horas.
Los pacientes menos graves pueden recibir antibióticos por vía oral como amoxicilina/ácido clavulánico, en dosis de 1 g (875/125 mg) por vía oral cada 12 horas o, en pacientes alérgicos a la penicilina, clindamicina en dosis de 300 mg por vía oral cada 6 horas. Los regímenes IV se pueden pasar a vía oral cuando el paciente mejora.
Para las infecciones muy graves con MSRA, el mejor tratamiento es linezolida o vancomicina.
Si se cultivan bacilos gramnegativos en concentraciones significativas de esputo o sangre y se identifican en la tinción de Gram, el régimen antibiótico debe modificarse para cubrir el patógeno específico además de los anaerobios.
La clindamicina en dosis de 600 mg IV cada 6 a 8 horas es el fármaco de elección porque tiene una excelente actividad contra estreptococos y microorganismos anaerobios; sin embargo, se ha convertido en un medicamento de segunda línea debido a la preocupación por la tasa elevada de infección por Clostridioides (antes Clostridium) difficile si la terapia con clindamicina se prolonga. Sigue siendo una opción útil en pacientes alérgicos a la penicilina.
No se sabe cuál es la duración óptima del tratamiento, si bien es habitual tratar hasta que la radiografía de tórax muestre la resolución completa o una pequeña cicatriz estable, residual, lo que suele tardar 3 a 6 semanas o más. En general, cuanto más grande es el absceso, más tiempo tarda para que se observe resolución en las radiografías.
La mayoría de los expertos no recomiendan la fisioterapia torácica y el drenaje postural, debido al potencial paso de la infección en otros bronquios con extensión de la infección u obstrucción aguda.
Debe drenarse el empiema acompañante. La extirpación quirúrgica o el drenaje de los abscesos pulmonares es necesario en alrededor del 10% de los pacientes en quienes las lesiones no responden a los antibióticos y aquellos que desarrollan gangrena pulmonar. La resistencia a la antibioticoterapia es más frecuente en las cavidades grandes y con abscesos posobstructivos. Si no desaparece la fiebre o los pacientes no mejoran clínicamente después de 7 a 10 días, deben ser evaluados para patógenos resistentes o inusuales, obstrucción de las vías respiratorias y causas no infecciosas de la cavitación.
Cuando la cirugía es necesaria, la lobectomía es el procedimiento más frecuente; la resección segmentaria puede ser suficiente para las lesiones pequeñas (cavidad < 6 cm de diámetro). La neumonectomía puede ser necesaria en el caso de abscesos múltiples que no responden a la farmacoterapia o de gangrena pulmonar. En los pacientes que puedan tener dificultad para tolerar la cirugía, el drenaje percutáneo o, raramente, la colocación broncoscópica bajo guía ecográfica de un catéter doble J puede ayudar a facilitar el drenaje. .
Conceptos clave
Los abscesos pulmonares son causados mayormente por la aspiración de secreciones bucales en pacientes que tienen alteraciones de la consciencia; por lo tanto, las bacterias anaerobias se encuentran entre los patógenos frecuentes.
Sospechar absceso pulmonar en pacientes propensos a la aspiración, que tienen síntomas constitucionales y pulmonares subagudos, y cuya radiografía de tórax muestra lesiones compatibles como cavidades.
Tratar inicialmente con antibióticos; si los pacientes no responden dentro de 7 a 10 días, evaluarlos para patógenos inusuales o resistentes, lesiones obstructivas bronquiales y causas no infecciosas de cavitación pulmonar.
Drenar empiemas y considerar la extirpación quirúrgica o drenaje de abscesos pulmonares que no respondan a la fármacoterapia y para la gangrena pulmonar.