Autor/a: Michael C. Ferrera,WassimW. Labaki, MeiLan K. Han Annual Review of Medicine. Vol 72:119-134
| Introducción |
La enfermedad pulmonar obstructiva crónica (EPOC), definida así recién a mediados del siglo XX, siguió cobrando gran interés por su heterogeneidad clínica y complejidad biológica.
Se considera la segunda enfermedad respiratoria más común en el mundo, con un aumento progresivo de su prevalencia.
Si bien el asma es más prevalente, la EPOC se asocia con mayor morbilidad y mortalidad). Debido a su elevada prevalencia y naturaleza progresiva, ha cobrado gran interés su fisiopatología y el diagnóstico precoz, para mejorar los resultados a largo plazo.
| Fisiopatología |
Hasta hace poco, la comprensión de la progresión de la enfermedad procedía del trabajo de Charles Fletcher y Richard Peto, que midieron el VEF1 de 800 hombres del oeste de Londres, de entre 30 y 59 años, cada 6 meses durante 8 años a partir de 1961. Ellos observaron una disminución continua y lenta del VEF1 que parecía acelerarse con el envejecimiento.
Los no fumadores perdieron el VEF1 lentamente con el tiempo y casi nunca desarrollaron obstrucción del flujo de aire. Los fumadores eran “susceptibles” o “no susceptibles”.
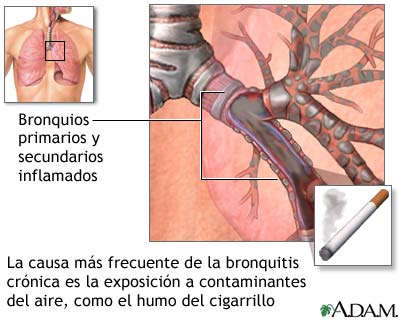
Los fumadores no susceptibles tenían una declinación del VEF1 similar a la de los no fumadores mientras que los fumadores susceptibles tenían una declinación más rápida del VEF1 que progresó hasta la obstrucción del flujo de aire. Por lo tanto, el paradigma dominante era que la exposición a partículas, normalmente en forma de humo de cigarrillo, provoca la aceleración de la declinación de la función pulmonar típica relacionada con la edad en los susceptibles a este efecto
Esta acepción no fue cuestionada hasta que estudios de cohortes contemporáneos ofrecieron nuevas perspectivas sobre las trayectorias de la función pulmonar a lo largo de la vida.
Lange et al. utilizaron datos de 3 cohortes de estudios de observación para identificar 2 trayectorias diferentes que pueden conducir a la EPOC. Algunos sujetos alcanzaron una función pulmonar normal en la edad adulta temprana seguida de una rápida disminución del VEF1, mientras que otros nunca alcanzaron una función pulmonar normal y desarrollaron EPOC a pesar de la disminución normal del VEF1 relacionada con la edad durante la edad adulta.
Por otra parte, muchos estudios de cohortes identificaron trayectorias de la función pulmonar desde el nacimiento o la niñez hasta la edad adulta temprana, que pueden reflejar la influencia de factores potencialmente modificables como el parto prematuro, la exposición al humo, las infecciones pulmonares recurrentes y el asma persistente durante la infancia, que podría ser el foco de las intervenciones para maximizar el crecimiento pulmonar y reducir el riesgo de EPOC en la vejez. Esta nueva comprensión de las trayectorias de la función pulmonar ha dado lugar a estudios sobre los primeros cambios fisiopatológicos en la EPOC para identificar a los pacientes con enfermedad temprana que puedan obtener mayores beneficios de la intervención.
El cambio histológico más temprano detectable después de la exposición al humo del cigarrillo es la reprogramación epigenética de las células epiteliales basales, esenciales para una defensa pulmonar eficaz y la remodelación epitelial después de una lesión pulmonar.
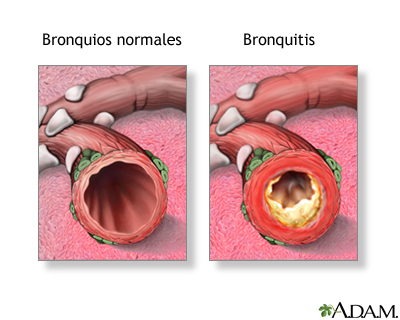
Debido a la reprogramación epigenética de estas células, las vías respiratorias distales exhiben metaplasia escamosa, disfunción ciliar, hiperplasia de las células basales y caliciformes e hipersecreción de moco, creando así un medio inflamatorio local propenso al daño y la infección. De hecho, un análisis de la expresión genética de muestras epiteliales respiratorias recopiladas de no fumadores sanos, fumadores sanos y fumadores con EPOC, demostró la reprogramación de las vías respiratorias distales para parecerse más a las vías respiratorias proximales en los fumadores, especialmente en aquellos con EPOC.
Se destaca que la reprogramación distal a proximal puede estar mediada por la señalización del factor de crecimiento epidérmico en las células basales de las vías respiratorias pequeñas, lo que podría representar un nuevo objetivo terapéutico.
La reprogramación epitelial inducida por la exposición crónica al humo del cigarrillo también cambia el volumen así como el contenido de agua y mucina del líquido de la superficie de las vías respiratorias. La estructura normal y la función de esta interfaz fisiológica previenen la obstrucción de las vías respiratorias, la inflamación y la infección mediante la eliminación eficaz del moco.
Se han hallado polímeros de mucina, que son carbohidratos de alto peso molecular, producidos por las células caliciformes, en concentraciones más elevadas en las muestras de esputo de fumadores con EPOC en comparación con los controles sanos y se asoció con el fenotipo clínico de la bronquitis crónica. Por lo tanto, la concentración de mucina en las vías respiratorias puede servir como biomarcador diagnóstico e identificar una posible diana terapéutica.
En el pulmón sano, las células de las vías respiratorias pequeñas secretan inmunoglobulina (Ig) A dimérica a la luz de la mucosa desde el receptor polimérico de Ig. La escisión de este receptor en la superficie luminal libera IgA secretora todavía unida a una porción del receptor denominada componente secretor. La IgA secretora ayuda a prevenir la invasión bacteriana del epitelio respiratorio.
Fumar reduce la expresión del receptor polimérico de Ig que lleva a una deficiencia localizada de IgA secretora en las vías respiratorias pequeñas. En ausencia de IgA secretora, las bacterias pueden invadir las células epiteliales respiratorias. La activación resultante del factor nuclear kB inicia y mantiene la inflamación de las vías respiratorias.
Las diferencias en las estructuras de la comunidad microbiana pulmonar también pueden ayudar a explicar por qué no todos los fumadores desarrollan EPOC sino cuáles son los microbios específicos que provocan la enfermedad. La progresión y el momento en que se producen son preguntas importantes que todavía no tienen respuesta.
Estos hallazgos sugieren que la invasión bacteriana puede ser un desencadenante que conduzca a la remodelación de las vías respiratorias. Puede ser una lesión patológica temprana clave que precede al desarrollo de enfisema.
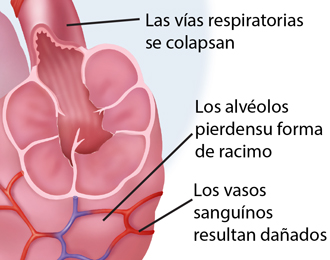
Mientras que originalmente se pensó que las vías respiratorias pequeñas contribuían muy poco a la resistencia total de los pulmones, trabajos posteriores a finales de los años 1960 y principios de 1970 demostraron que las vías respiratorias pequeñas son, de hecho, el principal sitio de mayor resistencia de las vías respiratorias en las personas con EPOC, y que estos cambios pueden ocurrir en ausencia de otra enfermedad pulmonar morfológica.
Por otra parte, los datos histológicos y de la tomografía computarizada (TC) sugieren que el estrechamiento de las vías respiratorias distales y, en última instancia, su disfunción, están presentes en la enfermedad leve, incluso antes de desarrollo de un enfisema manifiesto .
| Diagnóstico |
La EPOC sigue estando infradiagnosticada y mal diagnosticada.
Un análisis de la encuesta National Health and Nutrition Examination Surveys (NHANES) demostró que >70% de los participantes con obstrucción crónica de las vías respiratorias en la espirometría no tenían un diagnóstico formal de EPOC. En otro análisis de 5 planes de salud, solo el 32% de los pacientes con un nuevo diagnóstico de EPOC habían sido sometidos a una espirometría para confirmar su diagnóstico.
En 2016, el US Preventive Services Task Force confirmó una recomendación previa contra el cribado de adultos asintomáticos debido a la falta de evidencia de que la detección mejore los resultados clínicos a largo plazo.
Una advertencia es que algunos pacientes con EPOC pueden subestimar sus síntomas porque evitan las actividades que los inducen o los atribuyen a la falta de condiciones físicas o la edad avanzada.
Por lo tanto, a diferencia del cribado poblacional mediante la espirometría, se han adoptado diversos métodos de búsqueda de casos de EPOC. Uno de ellos combina un cuestionario de 5 ítems denominado CAPTURE (COPD Assessment in Primary Care to Identify Undiagnosed Respiratory Disease and Exacerbation Risk) mediante la medición del flujo espiratorio máximo. Este enfoque pragmático y de bajo costo, que actualmente se está aplicando en una población de atención primaria para su evaluación, fue sensible y específico para identificar a pacientes en riesgo de EPOC que luego podrían ser más evaluados con la espirometría.
La definición de EPOC requiere una espirometría post broncodilatación que demuestre un flujo de aire fijo y obstrucción, definida como una relación VEF1/capacidad vital forzada (CVF) <0,70. Sin embargo, todavía se debate si esta es la mejor opción para definir la obstrucción. Usando un límite fijo de VEF1/CVF, la definición de obstrucción del flujo aéreo ha sido recomendada por la Global Initiative for Chronic Obstructive Lung Disease (GOLD). La American Thoracic Society y la European Respiratory Society recomiendan usar el límite inferior normal (LIN) de VEF1/CVF, basado en cuenta la edad, la raza, el sexo y la talla de la población.
Si bien el límite fijo es más fácil de aplicar, puede dar más resultados negativos falsos en los pacientes más jóvenes, quienes pueden beneficiarse de una intervención temprana, y más resultados positivos falsos en los pacientes mayores, que pueden recibir un tratamiento innecesario. Un estudio prospectivo de Dinamarca (seguimiento 6 años) de gran cohorte mostró que los individuos con VEF1/CVF LIN pero ≥0,70 tenían una mediana de edad de 45 años y mayor riesgo de neumonía, insuficiencia cardíaca y mortalidad global comparados con aquellos sin obstrucción del flujo aéreo.
Según estos y otros estudios, el punto de corte óptimo de VEF1/CVF (fijo vs. LIN) para definir la obstrucción del flujo aéreo en la práctica clínica sigue siendo un tema de debate, pero está claramente influenciado por la edad. El informe GOLD de 2001 designó como GOLD 0 a los pacientes con VEEF1/CVF >0,70 pero con enfermedades respiratorias crónicas.
Los síntomas (tos crónica, producción de esputo e hipersecreción mucosa) catalogados como GOLD 0 son aquellos que corren riesgo de desarrollar obstrucción del flujo aéreo en el futuro. GOLD 0 siguió siendo una clasificación controvertida y finalmente se eliminó de los informes posteriores ya que estos pacientes no representan la mayoría de los que desarrollan obstrucción. A pesar de la eliminación de GOLD 0, se halló que los fumadores sin obstrucción del flujo aéreo pero con síntomas respiratorios crónicos experimentaban morbilidad respiratoria significativa.
Actualmente se está investigando a un subgrupo de estos fumadores con VEF1/CVF ≥0,7 pero VEF <80% del previsto , conocida como espirometría alterada de relación conservada (PRISm). El Estudio de Rotterdam mostró que un tercio de los participantes con PRISm hizo la transición a EPOC durante los 4,5 años de seguimiento, y que la presencia de PRISm y EPOC GOLD 2–4 fue predictora importante de mortalidad global. Se requieren estudios para este grupo, para hallar estrategias terapéuticas específicas y así retrasar o prevenir la EPOC.
Para caracterizar y comprender mejor los aspectos de la enfermedad pulmonar relacionados con el tabaquismo en ausencia de obstrucción del flujo de aire, la investigación está enfocada en los síntomas y exacerbaciones respiratorias y los hallazgos anormales en la TC de tórax. Entre los fumadores con VEF1/CVF >0,70, el estudio SPIROMICS mostró que aquellos con una alta carga de síntomas tenían más probabilidades de experimentar exacerbaciones respiratorias, menor tolerancia al ejercicio y signos de engrosamiento de las vías respiratorias en la TC de tórax, en comparación con aquellos con una carga de síntomas baja.
Se destaca que el 42% del grupo sintomático ya estaba tomando broncodilatadores inhalados y que el 23% los recibía combinados con corticosteroides, a pesar de que no había indicaciones para tal prescripción debido a la falta de obstrucción del flujo de aire.
Cada vez hay más pruebas de que los cambios en la TC pueden identificar a los pacientes con obstrucción del flujo aéreo entre fumadores y exfumadores. También hay pruebas de que un gran número de fumadores permanentes con VEF1/FVC ≥0,70 tienen signos radiológicos de enfermedad pulmonar (enfisema significativo o engrosamiento de la pared de las vías respiratorias), así como más disnea, menos tolerancia al ejercicio y más disfunción respiratoria en comparación con los que nunca fumaron.
En conjunto, estos resultados sugieren que las pautas actuales que requieren la obstrucción del flujo de aire para el diagnóstico de EPOC posiblemente no sean adecuadas para describir el espectro de enfermedades pulmonares sintomáticas relacionadas con el tabaquismo y se requieran otras pautas con otra definición más amplia, incluida la presencia de cambios en la TC de tórax.
Ha surgido un método prometedor que utiliza la TC para identificar a las personas con mayor riesgo de progresión de la enfermedad, a partir de una técnica analítica diseñada para identificar pequeñas anomalías de las vías respiratorias.
El mapeo de respuesta paramétrica (MRP) es una técnica de procesamiento de imágenes que utiliza el registro dinámico de imágenes apareadas de TC inspirada y espirada para clasificar áreas del pulmón como normales o atrapamiento de aire enfisematoso o no enfisematoso, conocido como enfermedad funcional de las vías respiratorias pequeñas. En los fumadores sin obstrucción del flujo de aire o con obstrucción leve a moderada, el MRP de la enfermedad funcional de las vías respiratorias pequeñas se asoció más estrechamente con la disminución del VEF1 durante 5 años de seguimiento que el MRP enfisematoso.
Es importante destacar que las métricas del MRP han sido validadas con tejido pulmonar humano extraído de pacientes con EPOC avanzada en el momento del trasplante de pulmón, para mostrar que el MRP de la enfermedad funcional de las vías aéreas pequeñas se correlaciona con la pérdida de bronquiolos terminales, así como con el estrechamiento, engrosamiento y obstrucción de los bronquiolos terminales supervivientes.
Estos resultados apoyan la hipótesis de que la pérdida de las vías respiratorias pequeñas ocurre antes de que el enfisema o una disminución significativa de la función pulmonar sean detectables, y que estos cambios puedan identificarse utilizando la TC de tórax con técnicas de procesamiento de imágenes adecuadas. Como tal, e MRP de la enfermedad funciona de las vías aéreas pequeñas puede ser un buen biomarcador para estudiar e identificar precozmente a la EPOC.
Otra área de investigación en curso son los biomarcadores séricos. Se buscan nuevos biomarcadores que sean modificables, se asocien independientemente con los resultados clínicos duros y resulten en cambios clínicos significativos. Un foco de las investigaciones ha sido el medio inflamatorio de la EPOC, habiéndose identificado muchos marcadores inflamatorios diferentes que son objetivos potenciales.
La proteína C reactiva ha sido identificada como un importante predictor de hospitalizaciones por EPOC y de mortalidad, independiente de la función pulmonar.
Se ha demostrado que ayuda a guiar el uso de antibióticos en las exacerbaciones de la EPOC ambulatorias. Los niveles elevados de fibrinógeno se asocian de manera similar con mayor riesgo de exacerbaciones graves de la EPOC, lo que resulta en hospitalización y mortalidad. Los eosinófilos de la sangre tienen relación con las exacerbaciones y la respuesta a los corticosteroides inhalados (CSI). El sRAGE (receptor soluble para el producto final de glicación avanzada) es otro biomarcador prometedor que parece desempeñar un papel mecanicista importante en la patogénesis del enfisema.
Al pensar en el concepto de EPOC precoz o preEPOC, se debe considerar la importancia de la edad. La enfermedad leve en un fumador de 80 años podría presentar un riesgo diferente que el mismo nivel de gravedad en un fumador de 40 años. Por lo tanto, se ha propuesto una definición de EPOC temprana que incorpora la edad. Requiere que los pacientes sean <50 años y tengan el antecedente de fumar ≥10 paquetes por año. También necesitan ≥1 de los siguientes:
a) Evidencia de obstrucción del flujo de aire, que se define como VEF1/CVF
b) Hallazgos de la TC compatibles con EPOC (enfisema visual, atrapamiento aéreo o engrosamiento bronquial) o
c) Disminución rápida de VEF1 (≥60 ml/año).
Un análisis reciente de un estudio de la población general de Copenhagen halló una prevalencia de EPOC temprana (VEF1/CVFFVC
| Tratamiento |
> Farmacoterapia
Según las recomendaciones de oro, el tratamiento inicial para la mayoría de los pacientes con EPOC sintomática generalmente incluye un broncodilatador, como un antagonista muscarínico de acción prolongada (LAMA, por sus siglas en inglés).
Un ensayo doble ciego con casi 6.000 participantes con EPOC moderada a grave y un historial de tabaquismo de ≥10 paquetes-año comparó el efecto del tiotropio con el placebo, sobre la función a largo plazo. Si bien el tiotropio no frenó la disminución del VEF1, sí mejoró la calidad de vida relacionada con la salud y se asoció con menos exacerbaciones de la EPOC después de 4 años de seguimiento.
Otro estudio de tiotropio controlado con placebo mostró que el tiotropio fue superior en la mejoría del VEF1 post broncodilatador a los 24 meses en pacientes con EPOC leve a moderada, redujo la declinación anual del VEF1 y arrojó una tasa más baja de exacerbaciones. Aunque el tiotropio no mejoró la declinación del VEF1, en aquellos con enfermedad grave, puede beneficiar la función pulmonar en las etapas tempranas o leves de la enfermedad.
Independientemente de la gravedad de la enfermedad, en pacientes con EPOC ha quedado bien establecida la utilidad de los LAMA para mejorar los síntomas, aumentar la capacidad de ejercicio y reducir la frecuencia de las exacerbaciones, lo que respalda su uso como terapia de primera línea para pacientes particularmente de la función pulmonar, aumentan la mortalidad, empeorando la salud y aumentando los eventos cardíacos. Es muy importante prevenir las exacerbaciones. El historial de exacerbaciones y carga de síntomas es una guía para el tratamiento farmacológico.
En los últimos años se ha evaluado clínicamente la eficacia de varias terapias con inhaladores, con el fin de reducir las tasas de exacerbación de la EPOC. El estudio FLAME mostró que la combinación LAMA/LABA (indacaterol-glicopirronio) fue más efectiva que la de LABA/ CSI (salmeterol-fluticasona). La información del ensayo IMPACT sobre la vía de tratamiento de la EPOC mostró que la combinación triple LAMA/LABA/ CSI (umeclidinio- vilanterol/fluticasona) fue mejor que el furoato-vilanterol para prevenir las exacerbaciones de la EPOC en pacientes con antecedentes de exacerbaciones y al menos obstrucción moderada en la espirometría.
El régimen de 3 inhalantes redujo la tasa de exacerbaciones moderadas o graves en comparación con cualquiera de las terapias duales.
A diferencia del estudio FLAME, el IMPACT mostró mayor reducción de las exacerbaciones con LABA/CSI que con LAMA/LABA. Para conciliar estos datos discrepantes cabe señalar que en el estudio FLAME se necesitaron 4 semanas previas de monoterapia con tiotropio lo que pudo ser beneficioso para los pacientes que estaban estables sin recibir CSI.
Actualmente, para la población de pacientes GOLD D (alta carga de síntomas y mayor riesgo de exacerbaciones), LAMA, LAMA/LABA y LABA/CSI son opciones potenciales para la terapia inicial, reservando la terapia triple para aquellos con exacerbaciones persistentes a pesar de la terapia inicial. La terapia triple también redujo la mortalidad global en comparación con LAMA/LABA.
Anteriormente había poca evidencia que guiara a los médicos cuando debían reducir el uso de CSI en pacientes sin exacerbaciones frecuentes, en quienes el beneficio no sería tan claro. El estudio SUNSET examinó la seguridad y eficacia de los CSI en la disminución escalonada de la terapia triple en la EPOC, incorporando a pacientes con EPOC estable (FEV1 40-80% del previsto) que recibían terapia triple a largo plazo, con ≤1 exacerbación moderada o grave anual previa.
Los participantes experimentaron una disminución significativa del V[EF1 (26 ml) tras la desescalada de la terapia triple con LAMA/LABA, aunque no se observaron cambios en la tasa de exacerbaciones. En particular, los pacientes con eosinofilia en sangre (≥300 células/μl) tuvieron mayor disminución en la función pulmonar y experimentaron más exacerbaciones después de suspendidos los CSI. Un análisis post hoc del ensayo WISDOM sobre la suspensión de los CSI y las exacerbaciones también mostró una asociación similar entre el uso de CSI, la tasa de exacerbaciones y el recuento de eosinófilos, ya que hubo más exacerbaciones después de la suspensión de los CSI.
Por otra parte, un análisis secundario del recuento de eosinófilos como una variable continua en el estudio IMPACT y no mostró diferencias en la reducción de las exacerbaciones entre el uso de LAMA/LABA/CSI y LAMA/LABA en el recuento de eosinófilos <100 células/μl, pero hubo efectos del tratamiento progresivamente mayores en los regímenes con CSI, con niveles más elevados de eosinófilos. Estos hallazgos con respecto a los eosinófilos se han incorporado a las pautas GOLD de 2019, que para guiar el aumento y la reducción del tratamiento integran el nivel de eosinófilos séricos, la disnea y el historial de exacerbaciones, lo que destaca que el uso de inhaladores está avanzando hacia un enfoque más basado en la precisión.
Dada esta asociación entre la eosinofilia y las exacerbaciones de la EPOC, los ensayos han evaluado los anticuerpos monoclonales IL5 mepolizumab y benralizumab, que actualmente están aprobados por la FDA de EE. UU. para el asma eosinofílica. Los resultados han sido discordantes y solo un estudio mostró claramente tasas más bajas de exacerbaciones.
Los medicamentos orales se han vuelto de uso común entre los pacientes con exacerbaciones frecuentes a pesar del tratamiento máximo con inhalador, y en aquellos con recuentos de eosinófilos <100 células/μl, que tienen menos probabilidades de beneficiarse de los CSI. Se ha demostrado que la azitromicina reduce las exacerbaciones cuando se administra como profilaxis a pacientes con EPOC y mayor riesgo de exacerbaciones. La investigación mostró poco efecto del tratamiento en los fumadores activos, lo que respalda que sea usada solo en exfumadores, monitoreando el intervalo QT, el electrocardiograma y la audición, por sus efectos adversos.
Otra posible preocupación es la resistencia antibiótica.
Se ha demostrado que el roflumilast, un inhibidor de la fosfodiesterasa-4 reduce las exacerbaciones y está indicado para pacientes con exacerbaciones recurrentes, VEF1 <50% predicho y el fenotipo de bronquitis crónica. La pérdida de masa muscular se ha asociado con la mortalidad y el riesgo de exacerbación entre los pacientes con EPOC.
En un ensayo reciente controlado con placebo en el que participaron pacientes con EPOC sarcopénica, el bimagrumab, un anticuerpo monoclonal que bloquea los receptores de activina tipo II, produjo un aumento en el volumen del músculo del muslo y la masa corporal magra total hasta la semana 24, pero no mejoró la función física. Aún no está claro si ese aumento de la masa muscular podría traducirse en una disminución de la morbilidad y mortalidad respiratoria.
| Rehabilitación pulmonar |
La rehabilitación pulmonar es una intervención longitudinal integral que integra ejercicios aeróbicos, entrenamiento de fuerza muscular y programas educativos para mejorar el estado físico y psicológico y el bienestar de los pacientes con enfermedades respiratorias crónicas. Se ha demostrado que las relaciones públicas aumentan la capacidad funcional, mejoran la calidad de vida relacionada con la salud y reducen las hospitalizaciones. Aun así, la rehabilitación pulmonar sigue siendo subutilizada, probablemente debido a la falta de conciencia de los prestadores proveedores, pagadores y pacientes, así como la falta de acceso.
Una gran observación surgida de un estudio de cohorte de beneficiarios de Medicare reciente, que fueron dados de alta después de una hospitalización por EPOC, mostró que el inicio de la rehabilitación respiratoria dentro de los 90 días posteriores al alta hospitalaria, 1 año después se asoció con menor mortalidad global en comparación con el inicio posterior o ningún inicio. Mientras que <2% de los casi 200.000 pacientes incluidos en el análisis iniciaron la rehabilitación dentro de los 90 días posteriores al alta, estos hallazgos deberían fomentar la mayor utilización y financiación de la rehabilitación pulmonar.
| Reducción del volumen pulmonar |
La cirugía de reducción del volumen pulmonar es una de las pocas opciones de tratamiento quirúrgico para pacientes con EPOC. Su premisa es que la extirpación del pulmón enfermo y enfisematoso permite la reexpansión del pulmón adyacente comparativamente sano. Se ha demostrado que la reducción del volumen pulmonar confiere un beneficio en la mortalidad de pacientes con enfisema predominante en el lóbulo superior y poca tolerancia a al ejercicio a pesar de completar la rehabilitación pulmonar. Aunque es una de las pocas terapias que demostró brindar beneficios en la EPOC, sigue siendo poco utilizada, probablemente debido a restricciones de acreditación, conceptos erróneos entre los médicos sobre los beneficios y riesgos del procedimiento y sus estrictos criterios de elegibilidad.
Las válvulas endobronquiales se han convertido en una posible alternativa para pacientes que no califican para la cirugía de reducción del volumen pulmonar. Los estudios LIBERATE e IMPROVE mostraron la mejoría de la función pulmonar en el enfisema heterogéneo grave utilizando el sistema de válvula de espiración. Estos ensayos controlados aleatorizados multicéntricos recientes evaluaron 2 tipos diferentes de válvulas endobronquiales y las compararon con el tratamiento médico óptimo.
Los criterios de inclusión fueron: obstrucción grave en la espirometría, evidencia de hiperinflación significativa en las mediciones del volumen pulmonar, distribución heterogénea del enfisema determinada por análisis cuantitativo de la TC y poca o ninguna ventilación colateral en los lóbulos objetivo e ipsilateral.
Ambos ensayos informaron una mejoría del VEF1 y del volumen residual en sus respectivos brazos de utilización de la válvula endobronquial. A los 6 y 12 meses del seguimiento también se observarvó la mejoría del estado de salud respiratoria y la distancia de la caminata de 6 minutos. Estos estudios han motivado la aprobación por la FDA del uso de estos dispositivos en pacientes con EPOC.
Existe un alto riesgo de neumotórax asociado con la colocación de la válvula, aunque después del procedimiento el neumotórax no produjo diferencias en los resultados clínicos a los 6 y 12 meses.
| Denervación pulmonar dirigida y reoplastia bronquial |
La denervación pulmonar dirigida utiliza la ablación broncoscópica por radiofrecuencia para alterar el sistema nervioso parasimpático pulmonar, que media el tono del músculo liso, la broncoconstricción refleja, la hipersecreción de moco y la inflamación de las vías respiratorias.
Mientras que un ensayo pequeño aleatorizado controlado doble ciego mostró una reducción de los eventos adversos respiratorios en pacientes con EPOC sintomática de moderada a grave, un ensayo aleatorizado más amplio evaluó la denervación para reducir las exacerbaciones de la EPOC.
La reoplastia bronquial es otro procedimiento broncoscópico que aplica campos eléctricos pulsados no térmicos a las vías respiratorias para eliminar las células productoras de moco en pacientes con bronquitis crónica. En ensayos pequeños y no controlados se ha demostrado que reduce los síntomas respiratorios así como la hiperplasia de las células caliciformes.
| Trasplante de pulmón |
Cada año se realizan más de 1.000 trasplantes de pulmón a pacientes con EPOC grave. Es la indicación más común de trasplante de pulmón en todo el mundo y la segunda más común en EE. UU.
Las guías más recientes de la International Society of Heart and Lung Transplantationy reconoce que el momento de la derivación para el trasplante es un desafío porque la evolución clínica de la EPOC suele ser prolongada y la supervivencia corto y mediano plazo es mayor que en otras enfermedades pulmonares.
Los pacientes con EPOC y sin contraindicaciones para el trasplante, que tienen un índice BODE (índice de masa corporal, obstrucción del flujo aéreo, disnea grave, capacidad de esfuerzo) de 5 a 6 con enfermedad progresiva, VEF1 <25% del previsto hipoxia o hipercapnia significativa debe derivarse a un centro de trasplantes para su evaluación.
| Oxigenoterapia |
Una de las primeras intervenciones para la hipoxemia grave fue la administración de oxígeno suplementario, lo que mejoró la supervivencia de la EPOC. El ensayo de oxigenoterapia nocturna NOTT, de 1980, demostró que la oxigenoterapia suplementaria mejoró la supervivencia en aquellos con hipoxemia grave en reposo, hipertensión pulmonar, insuficiencia cardíaca o hematocrito >55%.
El ensayo LOTT de 2016, de oxigenoterapia a largo plazo, mostró beneficios en la hipoxemia menos grave. El NOTT evaluó el uso de oxígeno en la hipoxemia moderada en reposo o en desaturaciones inducidas por el ejercicio y se halló que el oxígeno suplementario no tuvo efecto sobre cualquiera de los resultados medidos, incluyendo mortalidad y tiempo transcurrido hasta la primera hospitalización.
| Ventilación crónica no invasiva |
Se ha demostrado que la ventilación no invasiva mejora la supervivencia en los pacientes con exacerbaciones de la EPOC e insuficiencia respiratoria hipercápnica aguda.
Sin embargo, aún no se ha caracterizado completamente su papel rutinario en pacientes ambulatorios con EPOC e hipercapnia crónica estables. Sin embargo, no todos los estudios hallaron los mismos beneficios.
Una revisión reciente identificó la adherencia como un problema importante y señaló que la calidad de vida y la supervivencia parecen mejorar solo cuando se reduce con eficacia el CO2 crónicamente elevado.
| Conclusión |
La EPOC es una enfermedad respiratoria común asociada con una heterogeneidad clínica significativa y una elevada morbilidad y mortalidad.
Nuevas opciones de tratamiento, que van desde los farmacológicos inhalados y orales hasta los tratamientos intervencionistas quirúrgicos y broncoscópicos, han abierto la puerta a un enfoque terapéutico personalizado para los pacientes con EPOC.
Los continuos avances en la comprensión de la biopatología, el diagnóstico y el tratamiento centrados en pacientes susceptibles, aplicados tempranamente en el curso de la enfermedad, tienen el potencial de mejorar los resultados clínicos a largo plazo y ayudar a identificar terapias modificadoras de la enfermedad.
Resumen, traducción y comentario objetivo: Dra. Marta Papponetti