Autor/a: William McNulty, Giles Cox , Iain Au-Yong. Investigating the solitary pulmonary nodule. BMJ 2012;344:
Presentación de un caso
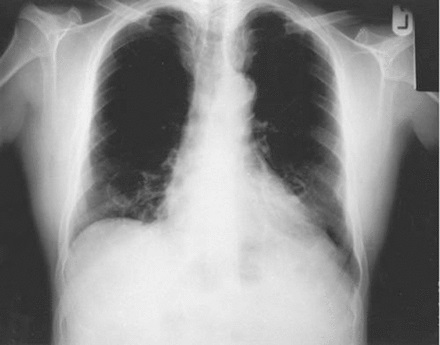
Un hombre de 81 años consulta en el departamento de emergencia por fiebre, tos, y dolor en el hemitoráx derecho durante la última semana. Había sufrido un infarto de miocardio en 2004, con buena evolución. Tiene el antecedente de haber fumado 50 paquetes-año. El examen clínico era normal. Su radiografía de tórax muestra un nódulo en el campo medio izquierdo. Fue tratado por una infección de las vías respiratorias inferiores y derivado a la clínica de cáncer de pulmón, con una cita de 2 semanas de espera.
Radiografía de tórax
A menudo, la radiografía de tórax es la primera investigación cuando se detecta un nódulo pulmonar solitario, definido como una opacidad redondeada, bien o mal delimitada, que mide hasta 3 cm de diámetro. Este nódulo puede representar el primer estadio de un cáncer de pulmón, y su detección y tratamiento precoz pueden mejorar los resultados clínicos. Sin embargo, algunos nódulos son benignos, y puede ser difícil determinar cuál requiere una investigación más profunda.
Causas más comunes de nódulo pulmonar solitario:
Malignos
• Carcinoma broncogénico
• Metástasis única
• Carcinoide benigno
Benignos
• Granuloma (tuberculosis a menudo curada)
• Tumores benignos (hamartoma, condroma)
• Neumonía redondeada o absceso
• AspergilomaNódulo reumatoide
• Malformaciones arteriovenosas
Las radiografías de tórax están fácilmente disponibles y tienen una dosis baja de radiación. Pueden ayudar a identificar las características del nódulo orientando sobre su causa. Los nódulos grandes, de bordes mal definidos, y rápido crecimiento posiblemente sean malignos. Sin embargo, la radiografía de tórax es menos sensible para identificar estas características que la tomografía computarizada (TC). Por otra parte, la mayoría de los nódulos se hacen visibles solo cuando alcanzan 1 cm de tamaño, de modo que pueden pasar desapercibidos fácilmente.
Los nódulos periféricos o los que están detrás o cerca de otras estructuras pueden quedar ocultos. Se estima que el 19% de los pacientes con cáncer de pulmón diagnosticado tienen nódulos pulmonares solitarios visibles en la radiografía de tórax previa, como se observó una vez que se volvieron a revisar. Puede haber positivos falsos por la mala interpretación de sombras compuestas, estructuras vasculares, lesiones en la piel y anormalidades costales. La comparación con radiografías antiguas es importante ya que las lesiones radiografías que permanecen estables durante 2 años rara vez son malignas. Otros aspectos radiográficos como la atelectasia lobular, la falta de resolución de una consolidación y los derrames pleurales pueden estar ocasionados por un cáncer de pulmón subyacente y requieren más investigación.
¿Cuál debería ser la siguiente investigación?
Cuando se descubre un nódulo pulmonar solitario, el primer paso es evaluar la probabilidad de cáncer de pulmón, sobre la base de los factores de riesgo de cáncer, como la edad y los antecedentes de tabaquismo. También se deben tener en cuenta el estado físico del paciente y las preferencias terapéuticas. Esto guiará las investigaciones siguientes y cómo se debe hacer el seguimiento del paciente. Tanto los factores clínicos como las características radiológicas de los nódulos influyen en la probabilidad de malignidad. Ambos han sido combinados en las herramientas para la evaluación del riesgo y permite calcularlo para cada paciente en particular.
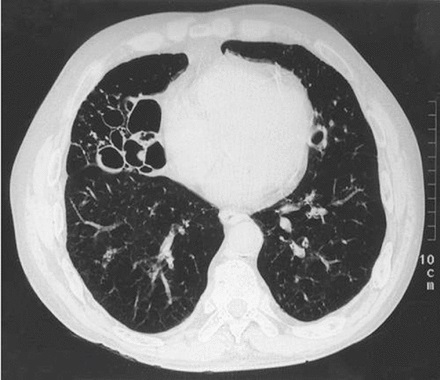
Tomografía computarizada
La TC de la parte inferior del cuello, el tórax y la parte superior del abdomen permite la caracterización precisa de los nódulos y la estadificación de las enfermedades malignas. La TC es muy sensible para detectar nódulos, a los que puede identificar a partir de los 2 mm de diámetro. Permite una mejor caracterización y puede sugerir características de malignidad o identificar características benignas como ciertos patrones de calcificación o el material de densidad grasa observado en los hamartomas.
La TC está ampliamente disponible y es bien tolerada, aunque los pacientes tienen que ser capaces de acostarse. Sus desventajas incluyen la dosis de radiación importante de aproximadamente 7 mSv (comparado con los 0:02 mSv que necesita la radiografía de tórax). El contraste intravenoso se excluye en los pacientes alérgicos al medio de contraste o con insuficiencia renal preexistente, lo que reduce la información que se puede obtener de la exploración.
La estadificación de la enfermedad maligna se logra evaluando el tamaño y la localización del tumor, la afectación ganglionar, y la identificación de metástasis. Sin embargo, la TC puede determinar con menos precisión que la tomografía computarizada por emisión de positrones (TCEP) si hay compromiso de los ganglios linfáticos mediastínicos.
Tomografía computarizada por emisión de positrones
La TCEP puede ayudar a determinar si el nódulo es maligno o benigno y está indicada cuando se considera que el paciente requiere un tratamiento radical. Esta tomografía combina la TC con la administración de glucosa radiomarcada, la cual es absorbida por los tejidos metabólicamente activos. La sensibilidad para detectar nódulos malignos es del 96% con una especificidad del 88% La TCEP también tiene una elevada sensibilidad para detectar la enfermedad metastásica y puede determinar con mayor precisión si los ganglios linfáticos mediastínicos están infiltrados, lo que permite clasificar al tumor más correctamente que la TC, asegurando que la indicación de un tratamiento radical es apropiada para determinado paciente.
Sus limitaciones son los positivos falsos dados por la absorción de la glucosa radiomarcada por lesiones inflamatorias como la neumonía o la tuberculosis antigua o los granulomas de la sarcoidosis. También el cerebro aparece "caliente", lo que limita la capacidad de detectar metástasis cerebrales. Las lesiones pequeñas por debajo de 1 cm pueden no ser alcanzadas por la resolución y sin embargo, podrían representar el inicio de un tumor o una metástasis. Igualmente, las lesiones “frías" con poca actividad metabólica también pueden ser tumores de baja grado, y si no son estudiados por biopsia se recomienda hacer el seguimiento con TC. La TCEP es un recurso limitado y costoso que lleva un tiempo prolongado de escaneo y dosis elevadas de radiación.
Biopsia pulmonar
Hay varias técnicas que se pueden usar para obtener tejido pulmonar de las personas con sospecha de cáncer de pulmón. Las guías actuales recomiendan hacer la biopsia del área que brinda la mayor información del estadio tumoral y es menos riesgosa para el paciente. Cuando la técnica menos invasiva falla, se puede recurrir a la resección quirúrgica de los nódulos y a la mediastinoscopia para obtener muestras de los ganglios linfáticos.
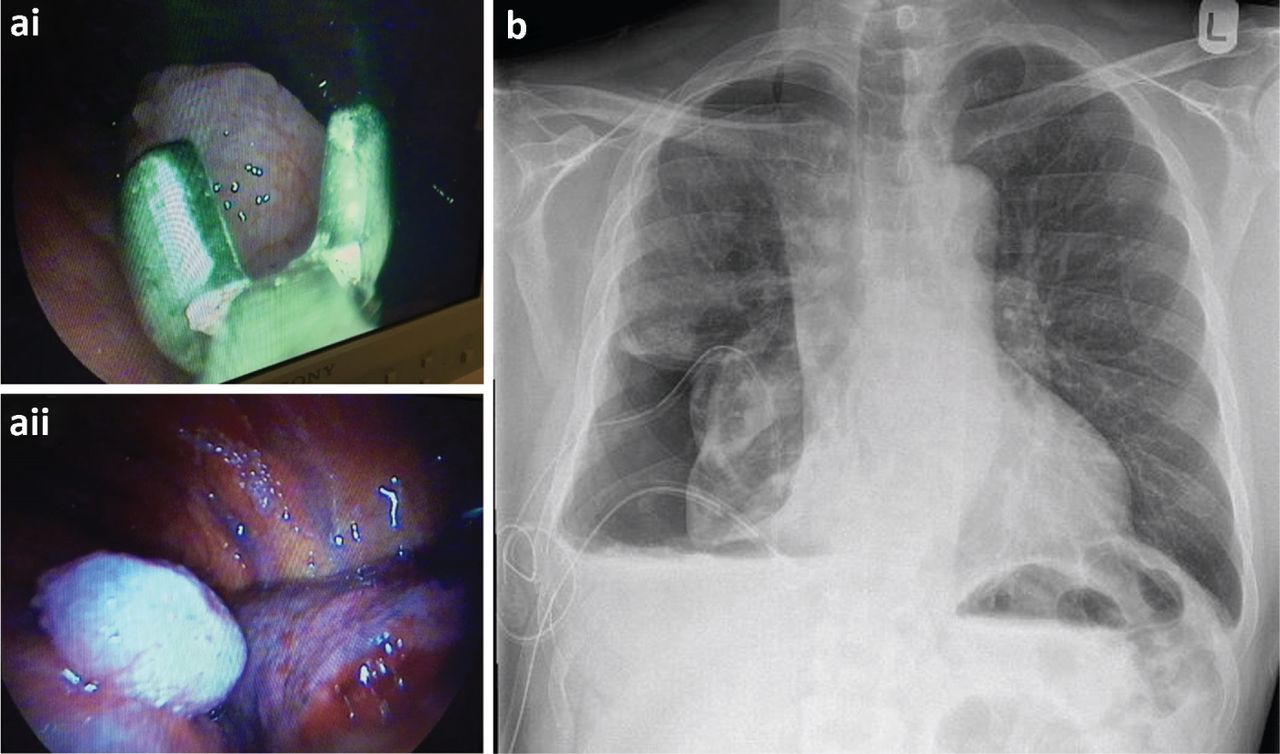
Broncoscopia y ecografía endobronquial
La broncoscopia flexible permite el examen de las vías aéreas centrales y la biopsia de las lesiones centrales para hacer el estudio histológico. Por lo general, son realizadas por los neumólogos o los cirujanos torácicos. El rendimiento diagnóstico de los nódulos pulmonares solitarios es pobre, aunque las técnicas nuevas como la ecografía endobronquial radial y la broncoscopia de navegación permiten un mejor acceso a las lesiones periféricas, pero su uso aún no se ha generalizado. Aunque es posible hacer la aspiración por punción transbronquial "a ciegas" de las adenopatías subcarinales, la información que brinda para la estadificación es poca. La ecografía endobronquial permite obtener imágenes en tiempo real y guiar la aspiración transbronquial con aguja de varias estaciones ganglionares mediastínicas y tumores peribronquiales. Un metaanálisis ha informado una sensibilidad del 88% y una especificidad del 100% para orientar la estadificación mediastínica de la enfermedad. La guía del National Institute for Health and Clinical Excellence (NICE) recomienda su uso estadificar la enfermedad y hacer la biopsia de los tumores paratraqueales o peribronquiales.
Biopsia con aguja transtorácica
La biopsia con aguja transtorácica con la guía de la TC o a menudo, con la guía ecográfica, suele ser el método disponible para la mayoría de los pacientes con un nódulo pulmonar solitario en quienes no se han encontrado metástasis. La sensibilidad de la biopsia transtorácica para la detección de lesiones malignas se estima en 86% y la especificidad en el 98,8%. Las complicaciones incluyen el neumotórax, aunque las tasas varían ampliamente dependiendo de si se usan los rayos X o la TC para la detección. Un extenso estudio reciente encontró que solo el 6,6% de los pacientes requirió un drenaje torácico con cánula. La hemorragia se presentó en el 1% de los casos. También hay riesgo de muestreo inadecuado y puede ser necesario repetir los procedimientos. Antes de realizar la biopsia se deben analizar la función pulmonar y la coagulación. Se prefiere un FEV1 >35% de lo previsto para evitar el compromiso respiratorio por un neumotórax. Para el procedimiento se deben suspender los anticoagulantes y los agentes antiplaquetarios como el clopidogrel, no así la aspirina.
Estudio de los nódulos pequeños
La TC es la técnica de elección para el seguimiento de las lesiones pequeñas indeterminadas detectadas en la radiografía de tórax o la TC. Las lesiones más pequeñas son difíciles de estudiar mientras están por debajo de la resolución de la TCEP y son difíciles de biopsiar. La guía de la Fleishner Society recomienda el seguimiento radiológico periódico de los nódulos, según el tamaño y el riesgo de malignidad. Cuando los nódulos aumentan de tamaño se requieren investigaciones adicionales como la biopsia o la TCEP. Los nódulos estables se deben seguir durante un máximo de 2 años. Este enfoque ofrece un equilibrio entre la identificación oportuna del cáncer y la carga de los escaneos, la exposición a la radiación y las complicaciones de los procedimientos.
Resultados del paciente presentado
La TC reveló un nódulo periférico de 17 mm estadificado como T1aN0M0. Se informó al paciente su diagnóstico y las opciones de tratamiento y se lo invitó a considerar la posibilidad de la cirugía. Se hizo la biopsia del nódulo por vía percutánea bajo control tomográfico, la cual se complicó con una neumotórax pequeño que no requirió tratamiento. La histología correspondió a un carcinoma de células escamosas. Como estudio prequirúrgico se hizo una TCEP que puso en evidencia ganglios linfáticos subcarinales de 6 mm, metabólicamente activos pero con un grado bajo de captación, sin otra evidencia de metástasis. Se discutió la a posibilidad de diseminación a los ganglios linfáticos y se ofreció hacer una ecografía endobronquial o una mediastinoscopia. En este punto el paciente rechazó la intervención quirúrgica por considerar que el impacto sobre la calidad de la vida superaría los beneficios a corto plazo. La estadificación radiológica final fue T1aNxM0.
Un enfoque alternativo siguiendo las nuevas recomendaciones de NICE sería ofrecer la TCEP antes que la biopsia. Si se identifica algún ganglio positivo, entonces se puede indicar la biopsia para obtener tanto el diagnóstico histológico como hacer la clasificación correcta en una sola prueba. El paciente permanece bien y asintomático luego de más de 12 meses de seguimiento a partir del diagnóstico.
Traducción y resumen objetivo: Dra. Marta Papponetti