Autor/a: Royal College of Physicians,a la orden del Dr John Firth Clinical Medicine 2019. Vol. 19. Nº 1, 64-67.
| Etiología |
Las bronquiectasias son una condición que se caracteriza por la dilatación permanente de los bronquios, causadas por una variedad de razones pero en más del 50% de los pacientes, no se encuentra una causa definida.
Puntos clave • Aumento del volumen del esputo |
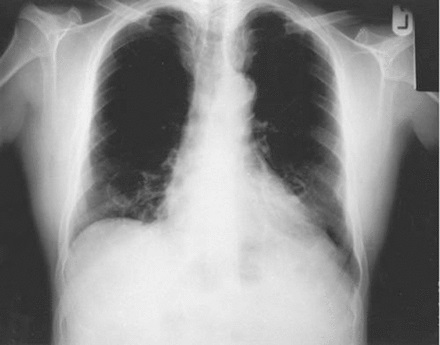
Radiografía simple de tórax. Las líneas de tranvía en el lóbulo inferior derecho son consistentes con las bronquiectasias.
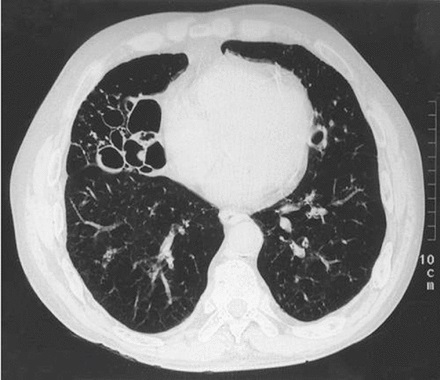
TC de alta resolución. Bronquiectasias bilaterales gruesas, más prominentes en el pulmón derecho, con el aspecto clásico de "anillo de sello" generado por un bronquio agrandado y un vaso vecino.
| Causas de bronquiectasias | |
| Causas | Ejemplos |
| Idiopática | |
| Postinfecciosa | Infección respiratoria en la infancia (sarampión, tos convulsa o bronquiolitis), neumonía, tuberculosis pulmonar y micobacterias no tuberculosis (por ej., Complejo Mycobacterium avium) |
| Obstrucción bronquial | Cuerpo extraño inhalado, tumor endobronquial, ganglio linfático extrínseco/compresión tumoral y síndrome del lóbulo medio |
| Defectos de la depuración mucociliar | • Genético: fibrosis quística y discinesia ciliar primaria. (síndrome de Kartagener) • Adquirido: síndrome de Young (azoospermia y sinusitis) e inhalación de gases tóxicos. |
| Inmunodeficiencia | Inmunodeficiencia variable común y VIH |
| Congénita | Deficiencia de α1 antitripsina, síndrome de Williams–Campbell (deficiencia del cartílago bronquial), síndrome de McLeod (enfisema unilateral) y secuestro pulmonar pulmón (no funcionante con irrigación sanguínea desde la aorta. |
| Hiper respuesta inmunológico | Aspergilosis pulmonar bacteriana alérgica y post trasplante de pulmón |
| Otros | Enfermedad por reflujo gastroesofágico, artritis reumatoidea, síndrome de Sjögren, lupus eritematoso sistémico, sarcoidosis, síndrome de la uña amarilla, colitis ulcerosa, síndrome de Marfan y síndrome de Ehlers-Danlos |
| Patología |
La colonización bacteriana recurrente y la infección provocan la lesión de la vía aérea mediada por neutrófilos, linfocitos T y citocinas impulsadas por los monocitos.
Los mediadores inflamatorios liberados, elastasa y colagenasa, provocan a su vez inflamación y posterior destrucción de los componentes elásticos y musculares de las paredes bronquiales, lo que lleva a la dilatación permanente de la pared bronquial.
> Presentación clínica
Las manifestaciones clínicas clásicas de las bronquiectasias son la tos y la producción diaria de esputo mucopurulento y adherente: >10 ml/día sugiere bronquiectasias leves; >150 ml/día indica bronquiectasias severas.
| Síntomas de bronquiectasias (frecuencia) | |
| Comunes | Tos (90%) Producción diaria de esputo (76%) Disnea (72%) Hemoptisis (50%) Dolor pleural recurrente |
| Infrecuentes | Sinusitis crónica |
| Signos de bronquiectasias (frecuencia) | |
| Comunes | Estertores (gruesos; al comienzo de la temprano y final de la espiratorio) (70%) Sibilancias (44%) Dedos en palillo de tambor (30%) Halitosis |
| Infrecuentes | Síndrome específico (por ej., uñas descoloridas/linfedema/ derrame pleural en el síndrome de uñas amarillas. Situs inversus en el síndrome de Kartagener |
> Investigaciones
Las investigaciones se realizan para confirmar la sospecha clínica de bronquiectasias, identificar cualquier causa subyacente potencialmente tratable y evaluar cualquier deterioro funcional y extensión de las bronquiectasias.
| Investigaciones en las bronquiectasias | ||
| Tipo de prueba | Descripción | Posibles hallazgos. Indicaciones |
| Genérico | Rx de tórax | Junto con la presentación clínica, puede ser suficiente para establecer el diagnóstico, aunque no siempre es anormal. Buscar líneas de tranvía (líneas gruesas paralelas representando paredes bronquiales engrosadas y dilatadas), opacidades anulares, sombras en bandas (bronquios rellenos de líquidas o moco), marcas bronquiales apiñadas resultantes de atelectasia y aspecto de "dedo en guante" (bronquios centrales impactados) |
| TC de alta resolución | Indicado si existe sospecha clínica de bronquiectasias pero la Rx de tórax es normal, existen otras anomalías en una Rx de tórax que necesitan aclaración, o si la cirugía puede ser contemplado. Una distribución central (perihiliar) sugiere ABPA y la distribución en el lóbulo superior sugiere FQ/TB pulmonar previa. | |
| Pruebas de función pulmona | Patrón obstructivo | |
| Gases en sangre arterial | Hipoxia y/o hipercapnia en enfermedad avanzada | |
| Cultivo de esputo | Haemophilus influenzas, Streptococcus pneu1moniae, Staphylococcus aureus (si es recurrente esto puede indicar una presentación atípica de FQ y Pseudomonas aeruginosa | |
| Broncoscopia | Para excluir cuerpo extraño/lesión endobronquial o evaluar y localizar la fuente de la hemoptisis | |
| Específicas para enfermedad subyacente | Inmunoglobulinas séricas | IgG/IgG específica (a neumococo y H. influenzae)/IgA |
| Concentración de Na en el sudor | FQ | |
| FQ | ||
| Eosinófilos/cribado de ABPA | ABPA | |
| ECA/calcio | Sarcoidosis | |
| Fr/ANA/ANCA | Artritis reumatoidea. LES. vasculitis | |
| ABPA: aspergilosis broncopulmonar alérgica. ANA: anticuerpos antinucleares. ANCA: anticuerpos antineutrófilos citoplasmáticos. ECA: enzima convertidora de angiotensina. FQ: fibrosis quística. Fr: factor reumatoideo. LES: lupus eritematoso sistémico. TB: tuberculosis | ||
> Microbiología
Los pacientes con bronquiectasias suelen experimentar infecciones recurrentes del tracto respiratorio. La prevención de la infección y el tratamiento inmediato de las exacerbaciones infecciosas agudas son la piedra angular del tratamiento, para minimizar el daño pulmonar y mantener la función pulmonar.
Antes de comenzar la administración de antibióticos se debe realizar el cultivo del esputo, cuando el paciente con bronquiectasias se halla en estado estable y también en el momento de la exacerbación.
| Puntos clave |
| Diagnóstico |
| Buscar siempre la causa de la bronquiectasia, ya que hallada, puede llevar a un tratamiento que retarda o detenga la progresión de enfermedad. |
| Tratamiento |
| Es esencial que el esputo del paciente se envíe por rutina. La microscopía bacteriana y micobacteriana y el cultivo antes de la indicación de antibióticos, al inicio de las exacerbaciones; el tratamiento no se aplazará a la espera de los resultados pendientes. |
| Tratamiento |
> Fisioterapia torácica
Es fundamental para el tratamiento, y se aconseja realizarla al menos 2 veces/día. Esto incluye el drenaje postural, el ciclo activo de técnicas respiratorias y los dispositivos espiratorios oscilantes positivos.
> Complementos para depurar el esputo
La solución salina nebulizada (normal o hipertónica) ayuda a eliminar el moco. Los mucolíticos (por ej., carbocisteína) se usan a menudo para reducir la viscosidad del esputo, aunque hay poca evidencia de beneficios provenientes de trabajos aleatorizados.
> Antibióticos para las infecciones agudas
Enviar esputo para cultivo. Comenzar los antibióticos en forma empírica, en un curso 14 días. Si el paciente no está respondiendo, ajustar el tratamiento antibiótico según el resultado del cultivo de esputo.
Si el paciente está muy mal, no ha respondido a los antibióticos orales o tiene organismos resistentes (a menudo Pseudomonas), están indicados los antibióticos por vía intravenosa.
> Antibióticos profilácticos a largo plazo
Considerar los antibióticos a largo plazo si hay más de 3 exacerbaciones por año.
Enviar esputo para estudio microscópico, cultivo y antibiograma y, cultivo de micobacterias. Seleccionar un régimen basado en la microbiología del esputo.
Los macrólidos pueden tener efectos antiinflamatorios, efectos modificadores de la enfermedad. El tratamiento prolongado con antibióticos nebulizados puede ser útil para pacientes con colonización crónica con Pseudomonas colomicina/gentamicina / tobramicina).
> Otros tratamientos médicos
Si hay evidencia de obstrucción del flujo de aire, se pueden administrar broncodilatadores. Los corticosteroides inhalados solo están indicados si hay asma coexistente.
> Técnicas de intervención
Si la fisioterapia ha fallado, para extraer el moco se puede utilizar la broncoscopia (toilet bronquial). La embolización de la arteria bronquial puede utilizarse para controlar la hemoptisis severa.
La cirugía se puede usar para la enfermedad localizada sintomática (pero antes de hacerlo, es esencial descartar una enfermedad sistémica que pudo haber dado lugar a las bronquiectasias que afectan el pulmón restante, por ejemplo, la inmunodeficiencia o la aspiración) o, la hemoptisis masiva.
El trasplante de pulmón se puede considerar para la etapa final de la enfermedad bilateral, generalmente en pacientes con fibrosis quística.
Tratamientos específicos • Reemplazo de inmunoglobulina en la inmunodeficiencia común variable. • Esteroides orales e itraconazol en la aspergilosis broncopulmonar alérgica (no hay datos sobre la eficacia del voriconazol u otros agentes imidazol en esta condición). • Supresión del ácido gástrico y procinéticos para la aspiración recurrente asociada con la enfermedad de reflujo gastroesofágico. • DNasa humana recombinante (rhDNasa) en la fibrosis quística. |
Complicaciones • Frecuentes: episodios infecciosos recurrentes, neumonías recurrentes y cor pulmonale. • Poco frecuentes: hemoptisis masiva, amiloidosis y absceso cerebral. |
> Pronóstico
Depende de la severidad, la colonización bacteriana (por ej., la colonización por Pseudomonas podría estar asociada con peor resultado) y la causa subyacente. El deterioro puede deberse a las recurrencias y al empeoramiento de la sepsis o, a la hipoxia y cor pulmonale.
Prevención • Vacunación contra el sarampión, la tos ferina, la influenza y la tuberculosis. • Tratamiento inmediato de las infecciones broncopulmonares y aspergilosis broncopulmonar alérgica. • Extirpación precoz de los cuerpos extraños y lesiones obstructivas. |
Resumen y comentario objetivo: Dra. Marta Papponetti