Autor/a: Dana Li, A Syed Ajmal, B Muhammad Modern day management of a unilateral pleural effusion
Introducción
Presentación de un caso Varón de 67 años con antecedentes de fibrilación auricular tratado con edoxabán que ha comenzado a empeorar 4 semanas antes de la consulta, con dificultad para respirar. Es tabaquista, con un consumo de 40 paquetes al año. Ha tenido exposición previa al asbesto por su actividad como constructor. El médico solicitó una radiografía de tórax donde se observa un derrame pleural unilateral (derecho) de tamaño moderado. |
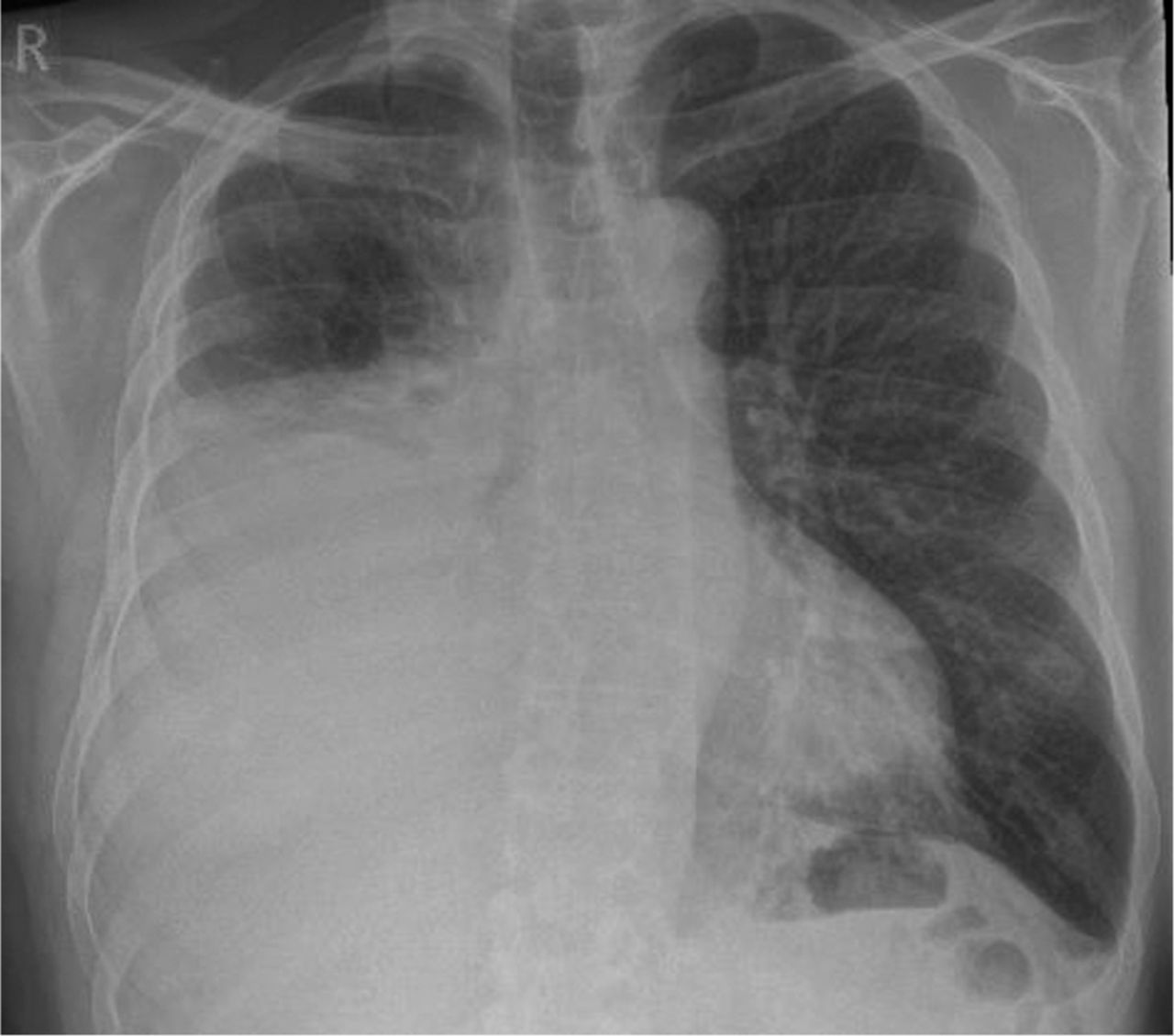
Figura 1: Radiografía de tórax inicial
¿Cuál es la causa de los síntomas de este paciente?
Algunos pacientes con derrame pleural pueden tener síntomas mínimos, pero otros pueden experimentar dificultad para respirar con poca capacidad para el ejercicio. Esto puede estar asociado con una saturación de oxígeno normal o reducida.
La fisiología de la disnea asociada con derrame pleural no se comprende bien, pero es probable que contribuya la reducción de la capacidad ventilatoria y el intercambio de gases, así como el movimiento anormal de los músculos respiratorios, con reducción de la expansión de la caja torácica y la ferulización del diafragma.
¿Cuál es la causa del derrame pleural?
Aunque se desconoce la etiología del derrame pleural de este paciente, ciertos factores de riesgo (incluidos los antecedentes de tabaquismo y la exposición al asbesto) los autores sospechan, en primer lugar, que se trata de un derrame pleural maligno. El dolor torácico ipsilateral puede sugerir un mesotelioma maligno.
Los derrames pleurales se clasifican por sus propiedades bioquímicas en exudados y trasudados, pero también puede deberse a sangre, pus y quilo.
Causas comunes de exudados y trasudados pleurales | |
Exudados IInfección (bacteriana, tuberculosis y parasitaria) Maligniidad (mesothelioma, cáncer de pulmón y de mama) Enfernedad del tejido conectivo (artritis reumatoidea) Condiciones inflamatorias inducidas por fármacos (por ej., infarto pulmonar) Pancreatitis aguda Quilotórax | Trasudados Insufriciencia cardíaca congestiva Cirrosis hepática Insuficiencia renal crónica Hipoalbuminemia
|
La aplicación de los criterios de Light puede ser útil para diagnosticar un derrame exudativo. Sin embargo, el 25% de los trasudados se clasifican erróneamente como exudados y, por lo tanto, puede ser necesario calcular el gradiente de albúmina suero/líquido pleural, con el fin de evitar un diagnóstico erróneo.
Criterios de Light para derrames exudativos Los derrames exudativos tendrán uno o más de los siguientes. > Proteína del líquido pleural / proteína sérica> 0,5. > LDH en líquido pleural / LDH en suero> 0,6. > LDH del líquido pleural> 2/3 del límite superior de LDH en suero |
LDH: láctico deshidrogenasa |
Los derrames exudativos están comúnmente causados por infecciones, malignidad y trastornos inflamatorios, como en la artritis reumatoidea. Los derrames pleurales malignos más comunes son los ocasionados por las neoplasias de pulmón y mama, y afectan hasta un 15% de los pacientes con cáncer.
Los derrames por trasudado, a menudo bilaterales, suelen estar causados por un desequilibrio entre las presiones oncótica e hidrostática, y se asocian con insuficiencia cardíaca, renal o hepática. Se ha demostrado que los derrames pleurales no malignos tienen tasas elevadas de mortalidad anual. Hasta el 30% de los derrames pleurales reciben un diagnóstico etiológico multifactorial, por lo tanto es esencial contar con un diagnóstico etiológico preciso, ya que eso afectará la elección del manejo posterior.
Una semana después, concurre a la consulta con un neumonólogo.
¿Cuál es la intervención más adecuada?
En pacientes con sospecha de derrame maligno no diagnosticado se puede realizar una aspiración pleural mientras se planifica la conducta a seguir, y cuál será la intervención útil si el líquido pleural tuviese células malignas.
Se suspendió el edoxabán durante las 48 horas previas al procedimiento debido al riesgo de hemorragia. Después de la aspiración de 1 litro de líquido pleural, los síntomas mejoraron. El líquido fue enviado al laboratorio para su análisis bioquímico (proteínas, deshidrogenasa láctica y glucosa), microbiológico y citológico.
La intervención en derrames pleurales se puede realizar con fines diagnósticos y terapéuticos. Si la causa del derrame es poco clara, se debe tomar una decisión sobre la intervención más adecuada, basada en:
- Los síntomas y/o el estado clínico del paciente.
- La etiología del derrame pleural (si ha sido establecida)
- Si es necesario realizar más estudios.
Cabe señalar que al realizar los procedimientos pleurales para la extracción de fluido es esencial utilizar una ecografía torácica inmediata o en tiempo real. En 2008, la OMS alertó sobre casos de muerte y daños graves provocados por la inserción de un drenaje torácico.
La British Thoracic Society (BTS) publicó recientemente estándares de formación en ecografía torácica para clínicos que también se ocupan del tratamiento de problemas respiratorios agudos y la realización de ecografías torácicas de emergencia.
Por otra parte, en presencia de coagulopatía están contraindicados los procedimientos no urgentes. Esa BTS aconseja evitar procedimientos en pacientes anticoagulados hasta que el RIN (relación internacional normalizada) sea <1,5.
En cuanto a los anticoagulantes orales directos, deben ser suspendidos durante 24 a 48 horas, dependiendo de la función renal y el riesgo de hemorragia, mientras que la heparina de bajo peso molecular terapéutica también se suspendida durante 24 horas.
Toracocentesis diagnóstica
En la mayoría de los pacientes, la investigación inicial apropiada es la toracocentesis diagnóstica.
Realizada bajo guía ecográfica es un procedimiento mínimamente invasivo que permite el análisis del líquido pleural con fines diagnósticos. En los derrames pleurales malignos la citología del líquido pleural tiene una sensibilidad diagnóstica variable. Las pautas anteriores de la BTS citaban una precisión diagnóstica del 60%, pero un estudio reciente halló que lLa sensibilidad de la citología es aproximadamente del 45% al 55%.
La sensibilidad diagnóstica es mayor en presencia de cánceres de ovario, mama y pulmón (adenocarcinoma), 95%, 71% y 82%, respectivamente. En el mesotelioma maligno, estudios anteriores mostraron una sensibilidad diagnóstica entre el 16% y el 73%. Aunque recientemente Arnold et al mostraron que la sensibilidad era más cerca del 6%.
Por otra parte, mientras que las pautas de la BTS aconsejan que para hacer el diagnóstico se requiere un volumen mínimo de 20-40 ml de líquido pleural, se ha comprobado que un volumen mínimo de 75 mL aumenta la sensibilidad diagnóstica.
Incluso si se obtiene un diagnóstico, el material puede no ser siempre suficiente para los marcadores moleculares/mutaciones driver (conductoras), que ayudarán en la toma de decisiones para la inmunoterapia o la terapia molecular dirigida.
Toracocentesis terapéutica
Toracocentesis terapéutica realizada bajo ecografía
La guía permite el análisis del líquido pleural para ayudar al diagnóstico, así como la extracción de un volumen mayor de líquido pleural para el alivio sintomático. El procedimiento evita la inserción de un drenaje torácico y, por lo tanto, se puede realizar en pacientes ambulatorios para evitar la hospitalización. Si la citología del líquido pleural no es diagnóstica, el líquido pleural residual requiere un procedimiento mayor, incluida la biopsia pleural guiada por imágenes o la toracoscopia con anestésico local.
Drenaje torácico intercostal
La inserción de drenaje torácico intercostal (DTI) realizada bajo guía ecográfica permite el análisis del líquido pleural, el drenaje completo del derrame pleural y la administración de agentes intrapleurales, si es requerido.
Comúnmente, se provoca la pleurodesis administrando una suspensión de talco a través del drenaje torácico intercostal para prevenir la recurrencia del derrame pleural maligno probable o confirmado. La pleurodesis con lechada de talco tiene una tasa de falla del 24%. Esta opción puede ser apropiada para pacientes sintomáticos con derrames pleurales de gran volumen que no deambulan, frágiles, en quienes otras pruebas invasivas pueden no ser apropiadas o cuando se conoce la etiología del derrame.
La guía del BTS recomienda precaución si se con las extracciones >1,5 l de líquido pleural en una sola ocasión debido al riesgo de desarrollar edema pulmonar de reexpansión, una condición que puede provocar tos, dolor en el pecho e incluso inestabilidad cardiovascular y colapso.
Otra alerta destaca la necesidad de garantizar un drenaje controlado para evitar esta posible complicación. Los médicos deben tener en cuenta que las intervenciones para el derrame pleural, a pesar del uso de la ecografía torácica, deben evitarse fuera del horario de atención, a menos que se trate de una emergencia, para minimizar errores y complicaciones.
Una radiografía de tórax posterior a la toracocentesis terapéutica reveló la formación de hidroneumotórax, lo que plantea la posibilidad de un pulmón no expandible. Se solicitó el análisis de líquido del derrame pleural exudativo (proteína de 40 g/l y LDH de 620 UI).
La citología reveló un derrame linfocítico sin células malignas. La tomografía computarizada (TC) de tórax demostró una corteza pleural parietal que abarca predominantemente al lóbulo inferior derecho, causando probablemente un pulmón no expandible.

Figura 2
a) Radiografía de tórax postoracocentesis con hidroneumotórax (aire y líquido en la cavidad pleural).
b) TC de tórax, vista coronal.
c) TC de tórax, vista axial.
¿Cuál es la intervención siguiente más adecuada?
Como la citología del líquido pleural no fue diagnóstica, el paciente fue sometido a una toracoscopía bajo anestesia local y sedación moderada (TAS), también conocida como toracoscopia médica o pleuroscopia. Es un procedimiento médico realizado por médicos neumonólogos, que incluye el examen interno, la biopsia y/o la administración de agentes terapéuticos dentro de la cavidad pleural.
Su principal indicación es el estudio de los derrames exudativos de etiología desconocida, particularmente cuando no hay un objetivo pleural para tomar la muestra de biopsia guiada por TC y la pleurodesis. También es útil para el diagnóstico de TBC pleural combinada con toma de muestras para cultivo e histología, con una sensibilidad de hasta el 100%, dependiendo de la prevalencia.
La eficacia de la TAS en el diagnóstico de malignidad es tan elevada como la de la biopsia en la cirugía toracoscópica asistida por video (CTAV). Esta biopsia, generalmente se hace bajo anestesia generales y ventilación unipulmonar. La TAS también se puede utilizar para indicaciones terapéuticas. se puede recurrir a la pleurodesis por polvo de talco si la pleura presenta aspecto anormal en inspección directa. Es tan eficaz como la lechada de talco para lograr una pleurodesis con mayor eficacia en pacientes con cáncer de pulmón o de mama.
La TAS también puede ser útil en las infecciones pleurales, lo que permite la división de tabiques y adherencias, y ayuda a colocar el drenaje del tórax con mayor precisión.
La TAS se puede realizar utilizando un toracoscopio semirrígido que tiene un diseño similar a un videobroncoscopio flexible o un toracoscopio rígido; ambos brindan una precisión diagnóstica similar.
El paciente se sometió a una TAS que mostró una amplia cantidad de nódulos sobre las pleuras visceral y parietal. Se decidió insertar un catéter pleural permanente (CPP) en el momento de la toracoscopia por un probable pulmón no expandible
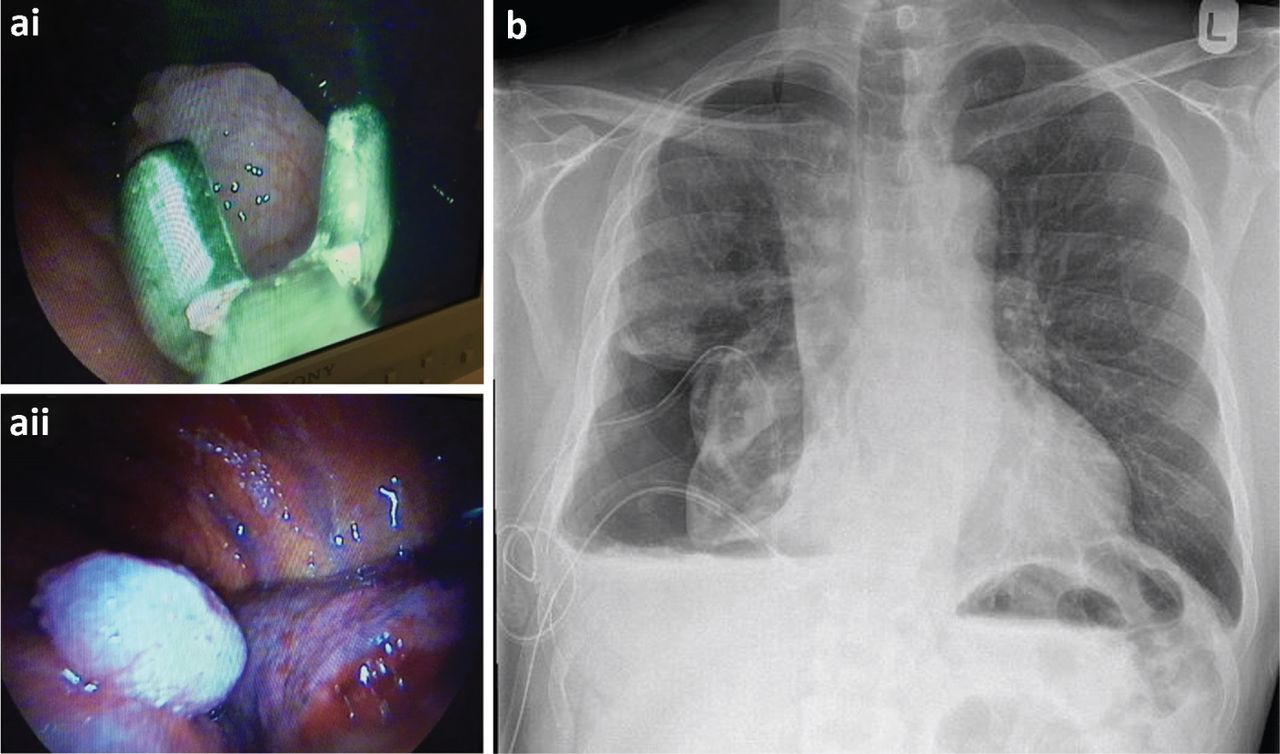
a) Biopsias de pleura parietal tomadas durante una toracoscopia y vista toracoscópica de un nódulo maligno. b) Postoracoscopia de radiografía de tórax.
¿Cuál es el papel de los catéteres pleurales permanentes (CPP)?
Los CPP son kconsiderados una herramienta importante en el manejo de los derrames pleurales. Un CPP es un tubo de silicona suave, flexible, con múltiples fenestraciones . Antes de entrar en la cavidad pleural, se introduce en un túnel subcutáneo.
Los CPP se diseñaron inicialmente como tratamiento de segunda línea para pacientes con derrame pleural maligno con pulmón no expandible o pleurodesis fallida, y pueden permanecen en la cavidad pleural y sobrevivir al paciente.
El pulmón no expandible (o pulmón atrapado) ocurre cuando el pulmón no puede expandirse después del drenaje del líquido pleural, ya sea por obstrucción endobronquial o recubrimiento de la pleura visceral por el tumor.
El papel de los CPP en el tratamiento del derrame pleural experimentó un cambio de paradigma a partir de la publicación de los ensayos TIME2 y AMPLE apoyando su uso como tratamiento de primera línea. Son seguros y reducen la duración de la estancia hospitalaria en pacientes que tradicionalmente habrían necesitado prolongadas y a menudo múltiples internaciones.
Los CPP han cambiado el manejo de los derrames pleurales, a un entorno más ambulatorio. El drenaje de los CPP es asistido por personal de enfermería, pero se puede asesorar y alentar a los pacientes a drenar y manipular sus propios dispositivos.
La frecuencia del drenaje es comúnmente 2-3 veces/semana, pero puede ser adaptado a las necesidades del paciente. Si el objetivo es paliativo, entonces el drenaje puede estar guiado por los síntomas. Sin embargo, si el objetivo es lograr una pleurodesis rápida con la posterior extracción del drenaje entonces el drenaje diario puede conducir a una mayor tasa de autopleurodesis y un tiempo más rápido para la eliminación del CPP. La autopleurodesis se define como la pleurodesis espontánea sin el uso de un agente químico.
Aunque no es el objetivo de la inserción de los CPP, se pudo observar hasta en el 51% de los pacientes con derrame pleural maligno. Por otra parte, el drenaje agresivo con la administración de talco a través del CPP puede resultar en tasas 2 veces más elevadas de pleurodesis en comparación con la inserción del CPP solo. El papel de los CPP en los derrames pleurales no malignos es menor definido y debe adaptarse al paciente.
El primer ensayo aleatorizado sobre trasudados pleurales refractarios llegó a la conclusión de que los CPP no ofrecían un control superior de la disnea en comparación con la toracocentesis terapéutica. En ese ensayo, el brazo de CPP experimentó más eventos adversos. En el hidrotórax hepático se puede colocar un CPP con intención paliativa, para los pacientes que han agotado el manejo médico y no son candidatos al trasplante, o para aquellos que requieren un tratamiento puente para manejar el derrame antes del trasplante.
A medida que el uso de los CPP se generaliza, los médicos pueden hallar más complicaciones relacionadas con su colocación, las que pueden ocurrir en el 10%-20% de los pacientes. la infección pleural, la obstrucción del catéter y las loculaciones sintomáticas tienden a ser las más comunes y pueden tratarse. En pacientes oncológicos, hay buena evidencia de que no existe mayor riesgo de infección relacionada con el CPP por quimioterapia, o de inmunosupresión.
Las biopsias pleurales revelaron mesotelioma epitelioide maligno. Tras la discusión por un equipo multidisciplinario, el paciente fue derivado a oncología para su tratamiento. El paciente continuó drenando su IPC 3 veces/semana y posteriormente consiguió la autopleurodesis. El CPP fue extraído poco después.
Resumen La investigación de un derrame pleural unilateral es un escenario clínico común al que se enfrentan tanto los médicos generales como los neumonólogos. Con la elevada prevalencia de los derrames pleurales malignos asociados al cáncer de pulmón y otras neoplasias en estadio avanzado, es cada vez más importante realizar los estudios correctos y de mayor utilidad. Esto es particularmente importante en relación a los avances en terapia oncológica, por lo cual, el diagnóstico basado únicamente en la citología pleural puede ser insuficiente, y la histología pleural complementaria puede proporcionar información adicional (incluido el análisis molecular) para guiar el tratamiento. Como ocurre con muchos aspectos de la atención médica moderna, la investigación y el manejo de los pacientes con derrames pleurales es cada vez más manejado de forma ambulatoria. Con la adopción de servicios de emergencia en el mismo día y clínicas pleurales en muchos hospitales, esto proporciona a los pacientes una atención optimizada, eficiente y eficaz. Esto ha sido particularmente relevante durante la pandemia de COVID-19 y reduce el costo y el riesgo de infección asociada al hospital paciente. Esto, junto con los dispositivos (como el CPP) que han sido diseñados específicamente para pacientes que desean permanecer en su hogar, ha permitido la aparición de un enfoque moderno de la medicina. |
Traducción y resumen objetivo: Dra. Marta Papponetti









