Microlitiasis alveolar pulmonar
La microlitiasis alveolar pulmonar (MAP) es una entidad rara que se caracteriza por la presencia de gránulos microscópicos de fosfato de calcio a nivel alveolar, conocidos como microlitos o calcosferitas1–4. Epidemiológicamente, el número de casos descritos en el mundo varía de acuerdo con las referencias bibliográficas, aunque no se superan los 600 casos1, sin predilección geográfica específica, reportándose casos en todos los continentes5–8. Se observa con más frecuencia en Europa y Asia, siendo los países con el mayor número de casos Japón8, Turquía9,10 e Italia11,12.
Se considera una enfermedad sistémica13 y se han descrito dos formas de presentación, la primera es de carácter familiar hasta en el 50% de los casos14 y la segunda de carácter esporádico, al no haber relación directa con los miembros familiares15.
La incidencia de acuerdo al género es variable, aunque en algunas series de casos se reporta de 2:1, mujeres a hombres con predominio de presentación familiar16, en otras series se hace referencia a mayor proporción en hombres, siendo la mayoría de presentación esporádica, como en los casos en que se toman radiografías de tórax de forma rutinaria para cumplir requisitos laborales o para enrolarse en el ejército8,12. La edad de presentación no está definida, dado que se reportan casos en todas las edades16, siendo la mayoría descritos entre la segunda y quinta década de la vida5,8,17.
En Colombia se conocen 6 casos que se pueden rastrear y referenciar por diferentes bases de datos (incluido este), con una presentación predominantemente familiar18–21.
Presentación de caso
Se trata de un hombre de 44 años de edad, quien consultó al servicio de urgencias del hospital por presentar un cuadro clínico de 6 días de evolución, consistente en dolor epigástrico, tipo ardor, asociado a náuseas y fiebre no cuantificada. Refería antecedentes de artritis reumatoide diagnosticada 15 años atrás, nefrectomía derecha por pielonefritis, consumo crónico de antiinflamatorios no esteroideos, enfermedad renal crónica secundaria, negaba estar tomando glucocorticoides; y manifestó como antecedente familiar la presencia de enfermedad pulmonar en un hermano (después precisada como MAP). Tabaquismo de 3,5 paquetes/año. No refería haber presentado síntomas respiratorios como tos o disnea, así como la presencia de polaquiuria. Negaba presentar inflamación articular o rigidez matutina y ocasionalmente dolor en la segunda articulación metacarpofalángica derecha.
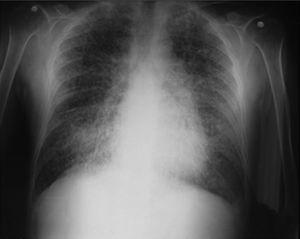
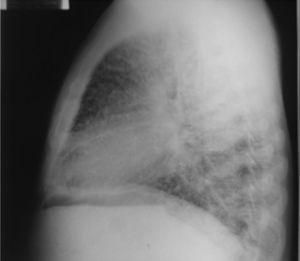
Al ingreso el paciente estaba afebril, deshidratado, con los siguientes signos vitales: presión arterial 120/75mmHg, frecuencia cardiaca 90 latidos por minuto, frecuencia respiratoria 18 respiraciones por minuto. Peso 47,5kg, talla 1,62 metros, índice de masa corporal 18,1 kg/m2. Saturación arterial de oxígeno de 91%, con fracción inspirada de oxígeno de 0,21. Al examen físico general no se encontraron ruidos agregados a la auscultación pulmonar, abdomen blando, sin presentar signos de irritación peritoneal. No se encontró inflamación o dolor articular, manos con deformidades en cuello de cisne y desviación cubital. Sin otras alteraciones llamativas. Electrocardiograma normal. El hemograma mostró anemia con volúmenes corpusculares normales, discreta leucocitosis a expensas de los neutrófilos y ligera trombocitosis. El nitrógeno ureico y la creatinina sérica estaban elevados, parcial de orina con presencia de leucocituria, hematuria, nitritos positivos además de cilindros granulosos. La radiografía de tórax reveló la presencia de opacidades micronodulares difusas en ambos campos pulmonares y en la tomografía de tórax de alta resolución se observaban pequeñas y numerosas calcificaciones del tamaño de «granos de arena».
Se consideró como probabilidad diagnóstica la tuberculosis miliar, por lo que se inicia tratamiento antituberculoso; el paciente evoluciona sin cambios en su estado, mejoría de sintomatología urinaria con inicio de antibiótico parenteral y mejoría del dolor abdominal, sin deterioro de su patrón respiratorio. Es valorado por el servicio de Neumología que considera que por hallazgos en la radiografía y tomografía de tórax es conveniente continuar con terapia antituberculosa y programar para fibrobroncoscopia. Posteriormente es valorado por el servicio de Nefrología que consideró seguimiento para eventual inicio de hemodiálisis.
Otros estudios mostraron factor reumatoide de 495 U/ml por nefelometría; niveles de ácido fólico, hierro sérico, transferrina, parathormona intacta, serología, ELISA VIH, serología para hepatitis B y C reportados como negativos y normales. Ecocardiograma transtorácico con fracción de eyección conservada de 65%, disfunción diastólica leve e hipertensión pulmonar leve.
Es llevado a fibrobroncoscopia donde se encontraron divisiones lobares y segmentarias normales, se realiza lavado broncoalveolar de segmento basal anterior izquierdo y se tomó biopsia transbronquial; el resultado del lavado broncoalveolar mostró escasos polimorfonucleares por campo, examen directo con hidróxido de potasio y coloración de Ziehl-Neelsen negativos, determinación de adenosina deaminasa negativa y cultivos negativos. El paciente evoluciona favorablemente sin disnea con resolución del dolor abdominal, con adecuada tolerancia a la terapia antituberculosa y se decide dar salida con orden de continuar tratamiento antituberculoso de forma ambulatoria y control en la consulta externa con reporte de patología. El paciente es valorado en la consulta externa de Neumología, donde se amplía la historia clínica con familiares refiriendo que al hermano se le diagnosticó MAP, 4 años atrás, con reporte de patología que sugería la presencia de MAP, por hallazgo de calcificaciones esféricas y lamelares, sin identificación de granulomas ni malignidad en el material revisado. Por tal motivo se decidió suspender terapia antituberculosa y continuar en control periódico por Neumología y Nefrología. La biopsia fue revisada por el servicio de Patología del Hospital Universitario Simón Bolívar de tercer nivel, así como del Instituto Nacional de Salud confirmando el diagnóstico de MAP.
Discusión
La MAP, fue descrita por primera vez en forma macroscópica en 1686, por Malpighi2. Posteriormente Friederich en 1856, es quien describe varias formas de cuerpos amiláceos en el pulmón, que sugerían estar dentro del alvéolo, similares a los de próstata3,22. Harbitz en 1918, suministra los hallazgos histopatológicos y Schildknecht (1932) los hallazgos radiológicos1. Pero es Ludwig Puhr quien en 1933, acuña el término mikrolithiasis alveolaris pulmonum3,13,23, como se conoce actualmente.
En 1947 Mariani et al., son los primeros en hacer una descripción completa de la enfermedad, desde los puntos de vista clínico, funcional y radiológico1,2, sin hacerse mención alguna de componente infeccioso14,24.
Se ha observado un componente hereditario, predominantemente un desorden autosómico recesivo5, reconociéndose la mutación en el gen SLC34A2 que codifica un cotransportador NaPi-II, este transportador es una proteína de membrana que se expresa predominantemente en los pulmones y glándulas mamarias de los mamíferos, menos reconocida en el intestino, riñón y próstata, siendo el único transportador de fosfato, expresado en los neumocitos tipo II. Es sabido que cuando el surfactante pulmonar es degradado o reciclado, quedan en el espacio alveolar fosfatos producto del metabolismo de los fosfolípidos y al estar presente la mutación sobre la proteína transportadora, se puede encontrar reducida la eliminación de estos fosfatos, con la consecuente formación de microlitos25–29.
Dentro de su etiología, se ha intentado asociar con componentes exposicionales18,30,31, específicamente al consumo de snuff en Tailandia, el cual es una mezcla de tabaco seco, goma oriental e ingredientes artesanales, que contienen altas concentraciones de carbonatos y fosfatos de calcio32.
Al momento del diagnóstico más de la mitad de los pacientes están asintomáticos y los hallazgos pulmonares se dan de forma fortuita33. El curso de la enfermedad es lento y progresivo. En la medida en que la enfermedad avanza, empiezan los síntomas, principalmente la disnea12. La tos parece no ser una queja común en la mayoría de los pacientes, aunque en algunos puede ser persistente34. Además, se describen astenia, dolor torácico, palpitaciones y pérdida de peso35, ocasionalmente la cianosis y el hipocratismo digital son los primeros signos clínicos1. Se han descrito también expulsión de microcálculos y hemoptisis20,36. Ya que la mayoría de la literatura es de reportes de casos, se desconoce el curso normal de la enfermedad, asumiéndose un curso crónico, sin presentaciones fulminantes, pero con progresiones rápidas especialmente en niños; lo común en la mayoría de los casos es que hay mala correlación entre los síntomas y los hallazgos radiológicos12,37. Dentro del espectro de la enfermedad se describen otros órganos comprometidos, aunque son raras estas complicaciones8, entre los que se encuentran los testículos (microlitiasis testicular) con subsecuente azoospermia, además de compromiso de sistema nervioso simpático38,39 y nefrocalcinosis40,41. Otros sitios aún menos frecuentes son el epidídimo, vesículas seminales y próstata2,42. Existen reportes únicos de compromiso en pericardio y osteoartropatía hipertrófica2,43. Actualmente, no se conoce terapia médica efectiva, en la mayoría de los casos el paciente sigue el curso natural de la enfermedad y se considera que puede estar asintomático durante décadas, la progresión de la enfermedad es lenta después del diagnóstico. Sin excepción, todos los pacientes sin tratamiento tienen desenlaces fatales secundarios a falla cardiaca o respiratoria1.
Para la realización del diagnóstico, se puede contar con diferentes medios, el más sencillo es el estudio directo de esputo en busca específica de microlitos, aunque su rendimiento diagnóstico es limitado1,3figuras 1–4.
La mayoría de los exámenes (creatinina, nitrógeno ureico, glucemia, uroanálisis) pueden encontrarse normales, ocasionalmente en el hemograma se encuentra poliglobulia5,8. Los niveles séricos de calcio, el magnesio y parathormona intacta son normales17, aunque hay descripción de pacientes con hipercalcemia (situación rara). Recientemente se reportan elevaciones de los niveles séricos de las proteínas A y D del surfactante pulmonar, considerándose que podría llegar a ser una herramienta para el seguimiento de los pacientes8.
Dentro de los exámenes diagnósticos se debe realizar, en primer lugar, una radiografía de tórax, que usualmente muestra calcificaciones micronodulares, bilaterales, opacidades reticulares lineales y uniformidad de tamaño de los microlitos distribuidos a lo largo de todo el árbol bronquial. Los anteriores hallazgos se han descrito como «tormenta de arena» (del inglés sandstorm)44 o «tormenta de nieve» (del inglés snowstorm)45, que predominan en las áreas basales y mediales del pulmón, con obliteración de los bordes cardiacos y diafragmáticos35.
Se observan depósitos en las superficies subpleurales, resultando en una opacidad lineal, que demarca las divisiones pulmonares y mediastinales46, conocida como línea negra pleural (del inglés black pleural line), la cual fue descrita por Felson, considerada como una ilusión visual secundaria a un área radiolucente que se da entre el parénquima pleural y las costillas45,47–50. Otros hallazgos típicos son pequeñas bulas apicales e imagen en panal de abejas, sin mención de compromiso de nódulos linfáticos51.
Los hallazgos en la tomografía de tórax muestran nódulos calcificados intraalveolares bilaterales20,35, además pueden observarse áreas de alta atenuación en vidrio esmerilado los cuales pareciesen corresponder a pequeños depósitos de microlitos (inferiores a un milímetro), con predilección por las bases pulmonares y segmentos posteriores52. Cuando estas áreas de vidrio esmerilado se asocian con engrosamiento de los septos se conocen como patrón de «crazy-paving» o «patrón en empedrado», presentación poco frecuente47,51. Otros hallazgos observados en estadios avanzados de la enfermedad son la presencia de neumotórax espontáneo53, menos frecuente nódulos calcificados, quistes de aire subcondral y nódulos confluentes que eventualmente pueden formar consolidaciones en el espacio aéreo20,54.
Cuando se utiliza la gammagrafía pulmonar con tecnecio 99, ayuda a confirmar la naturaleza cálcica de las lesiones pulmonares, con intensa captación difusa del radioisótopo a nivel pulmonar. Se debe aclarar que en estadios tempranos de la enfermedad puede no haber una captación significativa del tecnecio 9947,55.
Cuando la MAP es sospechada en casos de presentación esporádica y teniendo imágenes diagnósticas anormales, es necesaria la utilización de otros test diagnósticos, como la broncoscopia y el lavado broncolaveolar56,57, con el que se puede demostrar la presencia de microlitos, complementado con la toma de biopsia por broncoscopia, especialmente en pacientes pediátricos. Hoy en día es muy rara la utilización de biopsia a cielo abierto, aunque en algunos casos es necesaria3,58,59.
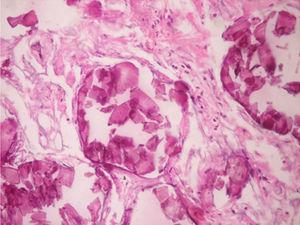
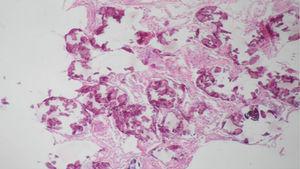
En los hallazgos histopatológicos, se encuentran numerosas calcosferitas laminadas, escasa fibrosis de las paredes alveolares y presencia de macrófagos cargados de hemosiderina. Siendo este el reporte de un gran número de casos. El parénquima pulmonar, en la medida que progresa la enfermedad, se degenera causando bulas y fibrosis intersticial. Se describen casos en los que las calcosferitas comprometen las paredes septales, no solo a nivel del espacio alveolar, sino también a nivel bronquial3,22.
En aquellos casos en que existe el antecedente familiar de MAP, el diagnóstico se establece con el cuadro clínico y los hallazgos imagenológicos ya sea radiografía o tomografía de tórax con infiltrados pulmonares con patrón en tormenta de arena, calcificaciones micronodulares a lo largo de los paquetes broncovasculares, engrosamiento de los septos interlobulares, que comprometen de manera predominante y simétrica a los lóbulos inferiores, sin necesidad de someter al paciente a pruebas invasivas como fibrobroncoscopia y lavado broncoalveolar.
Cuando los microlitos se analizan, se observan de forma irregular, redondeados y en ocasiones ovalados, compuestos de láminas con medidas que pueden variar de 0,01 a 0,3mm55, que parecen aumentar en tamaño con la edad hasta ocupar todo el espacio alveolar60 y en estados avanzados entran en contacto con la paredes, dañándolas y siendo estas reemplazadas por tejido fibroso. Los microlitos son compuestos de calcio, fósforo, con concentraciones bajas de hierro, cinc, aluminio y magnesio1,22,61. Su ubicación se da en principio en los lóbulos inferiores, con el trascurrir del tiempo (20 a 30 años), se extienden a todo el pulmón.
La mayoría de los pacientes reportados en la literatura cursan con anormalidades en las pruebas de función pulmonar, predominando la reducción del volumen espiratorio forzado en el primer segundo y la capacidad vital, además de disminución de capacidad residual funcional, volumen residual y capacidad total pulmonar3,5,62.
La PAM se ha encontrado relacionada con otras enfermedades tales como la tuberculosis (en ocasiones este es el primer diagnóstico sospechado), la neumonitis intersticial linfocítica, pneumonoconiosis y la estenosis mitral2.
Hay publicaciones donde se han planteado diferentes medidas terapéuticas con miras a la remoción intraalveolar de las calcosferitas. La primera medida que se planteó fue la utilización de lavado broncoalveolar, medida que no reportó mejorías clínicas ni beneficios importantes para el paciente, a pesar que se observara que el líquido extraído fuese de aspecto arenoso3,24,60. Otra medida ha sido la utilización de sustancias quelantes y glucocorticoesteroides, que igualmente obtuvo resultados poco satisfactorios63. En estados avanzados, como medida de manejo sintomático se ha planteado la utilización continua de oxígeno, con presión positiva, con resultados paradójicos. Hay descripción de la utilización de etidronato sódico, compuesto conocido por inhibir la formación de hidroxiapatita, con mejoría de los infiltrados pulmonares1,3,64, sin embargo, ninguna de estas medidas ha mostrado resultados contundentes como para ser establecida como un tratamiento definitivo. Existe un reporte de caso de 2 pacientes con diagnóstico a los 5 y 9 años de edad que recibieron tratamiento con etidronato durante 9 y 11 años, respectivamente, donde se constató mejoría clínica y radiológica. No existen indicaciones claras para la realización de trasplante pulmonar debido a la falta de índices pronósticos y a la naturaleza insidiosa de la enfermedad, sin embargo, es la única medida efectiva y debe considerarse cuando exista falla cardiaca derecha o insuficiencia respiratoria grave; para maximizar las posibilidades de éxito los pacientes deben ser referidos antes de presentar disfunción grave del ventrículo derecho1,3,64.
El presente caso reportado hace referencia a un caso de MAP, diagnosticada mediante imágenes diagnósticas y estudios anatomopatológicos, que fueron revisados por varios especialistas en las áreas de neumología y patología de la ciudad de Bogotá.
Se esclareció este diagnóstico, dado que el hermano del paciente presentaba una entidad, que en principio el servicio desconocía pero que se había establecido varios años atrás como MAP, después de un chequeo médico de rutina. Se intentó tener acceso a los datos clínicos del hermano, pero no fue posible, se rescató una radiografía suministrada por el mismo familiar, de cuando se hizo el diagnóstico.
Una vez conocida esta información se citó a los otros hermanos, pero solo se tuvo acceso a la radiografía de la hermana mayor, que no mostraba anormalidad alguna.
Responsabilidades éticasProtección de personas y animales
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.